Introducción
Ante ciertas patologías cardiovasculares, el riesgo de padecer un evento tromboembólico aumenta. El uso de terapia anticoagulante
oral en la prevención primaria y secundaria ha demostrado disminuir el riesgo de accidentes cardiovasculares y la morbilidad en este tipo de
pacientes (Gazit et ál., 2016).
La fibrilación atrial es la indicación más frecuente para recibir este tratamiento, Con al menos 3 a 6 millones de afectados por esta patología en los Estados Unidos, esperando una proyección de estos valores hasta 6 a 16 millones de individuos en 2050.
En Europa, la prevalencia de fibrilación atrial en 2010 fue de 9 millones en individuos mayores a 55 años, y se estimó una proyección de 14 millones de afectados en 2060 (Di Carlo et ál., 2019; Kornej et ál., 2020).
En cuanto a los pacientes afectados con esta enfermedad, el 78% se encuentra en tratamiento con anticoagulantes orales, y la cifra va en crecimiento por la incorporación de nuevos fármacos, más seguros y con un rango terapéutico más amplio (Grymonprez et ál., 2022).
A pesar de que la mayoría de los tratamientos dentales son de bajo riesgo, los pacientes con una alterada coagulación requieren especial cuidado para evaluar el riesgo de sangrado que presenten y de tal modo prevenir y/o manejar, cualquier tipo de evento desafortunado (Costa- Tort et ál., 2021).
En vista de este crecimiento exponencial del uso de anticoagulantes orales de uso crónico, el objetivo de este trabajo es establecer el manejo estomatológico del paciente que se encuentra en tratamiento de anticoagulante oral mediante una revisión profunda de la literatura.
Hemostasia
La hemostasia es un proceso complejo que involucra la acción de plaquetas, factores de coagulación (tabla 1), y endotelio en el sitio de injuria vascular. Culmina con la formación del coágulo sanguíneo, el que cumple la función de prevenir o limitar el sangrado. Sus etapas corresponden a: i) hemostasia primaria, ii) hemostasia secundaria y iii) fibrinolisis (Guerrero & López, 2015).
La hemostasia primaria inicia casi de forma inmediata al momento de producirse la lesión vascular, en este proceso, interacciona principalmente las plaquetas y la pared vascular con el objetivo de limitar y detener la extravasación vascular en los capilares, arteriolas y vénulas.
En esta etapa, como primera instancia, ocurre una vasoconstricción vascular seguido por el reclutamiento y activación de las plaquetas, las cuales se adhieren al vaso lesionado, formando el tapón plaquetario. Este proceso se media principalmente por las prostaglandinas tromboxano A2 y prostaciclina y el factor Von Willebran (Gale, 2011).
La hemostasia secundaria, interaccionan principalmente los factores de coagulación entre sí, donde la exposición del factor tisular en el sitio dañado se une y activa el factor Vll, dando inicio a una cascada de reacciones que culmina con la generación de trombina. Esta ancla el fibrinógeno circulante en fibrina soluble, creando una malla de fibrina, la cual reforzará el tapón plaquetario (Hatton et ál., 2013) .
Por último, en la fibrinolisis se degrada las redes de fibrina presente en el coàgulo de fibrina mediante la inhibición de la formación de plasmina, inhibiendo el activador tisular del plasminógeno mediante la liberación por parte de las células endoteliales de inhibidor del activador del plasminógeno. La plasmina degrada el polímero de fibrina en pequeños fragmentos, los cuales, son eliminados por los macrófagos (LaPelusa & Dave, 2022)
Materiales y método
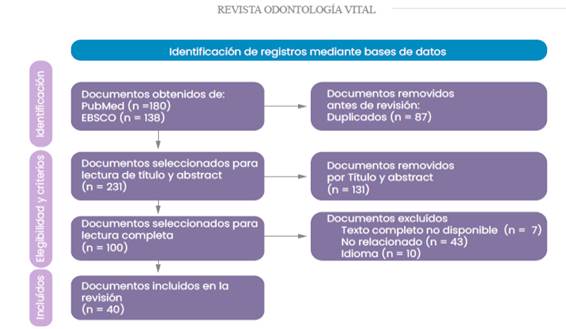
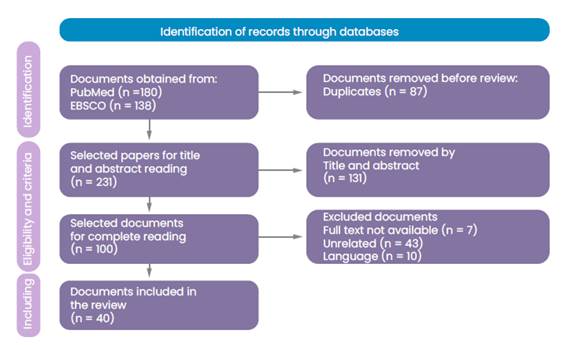
Se realizó una búsqueda de revisión bibliográfica manualmente de artículos indexados a las bases de datos de PUBMED y EBSCO que correspondiesen a las palabras “bucal surgery”, “oral hemorrhage”, “anticoagulants” y “dental care”. En cuanto a los criterios de inclusión, se consideraron revisiones bibliográficas, estudios observacionales, ensayos clínicos, guías, revisiones sistemáticas y metaanálisis publicados entre noviembre de 2005 y 2022, en idiomas inglés o español.
De esta estrategia de búsqueda se obtuvo un total de 322 artículos, de los cuales 274 fueron excluidos (duplicados, texto no disponible, etc.).
Dio como resultado un total de 44 artículos para esta revisión literaria (Figura 1). La información recabada fue revisada de forma exhaustiva en su totalidad.
Cascada de la coagulación
El modelo clásico de la coagulación fue descrito por Davie y Ratnoff en 1964 y separa las fases celular y humoral, dando protagonismo a la serie de reacciones enzimáticas que ocurren dentro de la hemostasia secundaria (Kumar et àl., 2015), la cual inician mediante la vía intrínseca que inicia tras un daño vascular, con la exposición de superficies cargadas negativamente que interaccionan con los factores de Hageman (FXII), antecedente tromboplastínico del plasma (FXI), precalicreína (PK) y los quinógenos de alto peso molecular (QAPM) y la vía extrínseca la cual inicia con la formación del complejo Tenasa Extrínseco conformado por el factor tisular (FT), el factor VIIa circulante, iones Ca++ y fosfolípidos (Smith et àl., 2015).
Estas dos vías convergen en la activación de fibrina, lo que culmina en deposición de un coágulo insoluble (Figura 2). La formación de este coágulo involucra enzimas (factor de coagulación activado), un sustrato (una forma inactiva del factor de coagulación pro enzimático) y un cofactor (Onishi et ál., 2016).
Tabla 1 Características bioquímicas y función de los factores de la coagulación (Adaptado de Guerrero et ál., 2015)
| FACTOR | CONCENTRACIÓN PLASMÁTICA (MG/DL) | TIEMPO DE VIDA MEDIA (HORAS) | FUNCIÓN |
|---|---|---|---|
| XI | 0,4-0,6 | 45-80 | En su forma activada es el activador intrínseco del FIX |
| XII | 1,5-4.5 | 50-70 | Iniciador de la vía intrínseca |
| PRECALICREÍNA | 1,5-4,5 | 36 | Precursor de la calicreína |
| QUININÓGENOS DE ALTO PESO MOLECULAR | 8-9 | 144-156 | Cofactores en la activación de Precalicreína FXI y FXII |
| II | 10-12 | 60-72 | Precursor inactivo de la trombina |
| VII | 0,05-0,06 | 4-6 | Junto al Factor Tisular inicia la vía extrínseca |
| IX | 0,4-0,5 | 18-25 | Precursor inactivo de la trombina |
| X | 0,7-1,2 | 24-40 | Junto al factor Tisular inicia la vía extrínseca |
| PROTEÍNA C | 0,39-0,59 | 8-14 | En sur forma activa es la enzima del complejo tenasa intrínseco |
| PROTEÍNA S | 2,5 | 40-60 | Cofactor de la PCa |
| PROTEÍNA Z | 0,22 | 60 | Incrementa la inhibición del FXa por el Inhibidor de la Proteína Z |
| V | 0,4-1,4 | 12-36 | Cofactor del complejo protrombinasa |
| VIII | 0,5-1 | 8-12 | Cofactor del complejo tenasa intrínseco |
| TROMBOMODULINA | 0 | Cofactor de la trombina | |
| FACTOR TISULAR | 0 | Inicia la vía extrínseca al unirse al FVIIa | |
| FIBRINÓGENO | 200-400 | 90 | Precursor de la fibrina |
| XIII | 1-2 | 168-288 | Trasnaminasa que entrecruza la fibrina |
| ANTITROMBINA III | 15-20 | 68 | Serpina que inhibe a la trombina y a los factores VIIa, IXa, Xa, Xia, XIIa y calicreína |
| COFACTOR II DE LA HEPARINA | 6,1-8,2 | 60 | Serpina que inhibe a trombina |
| INHIBIDOR DE LA PROTEÍNA C | 0,5 | 23,4 | Serpina que inhibe PCa, trombina, calicreína, FXIa, FXIIa y al componente C1 |
| INHIBIDOR DE LA PROTEÍNA Z | 0,1-0,16 | SERPINA QUE INHIBE FXA Y FXIA | |
| INHIBIDOR DE LA VÍA DEL FACTOR TISULAR | 0,006 | 1-2 | INHIBIDOR TIPO KUNITZ DE LOS COMPLEJOS TF/FVIIA/FXA Y DEL PS/FXA |
Este proceso es calcio dependiente, el cual se une a un residuo de ácido glutámico y-carboxilado presente en los factores ll, VI, IX Y X. Esta reacción es dependiente de Vitamina K, donde su forma reducida es esencial para activar los factores anteriormente mencionados.
De tal modo, la Vitamina K es un blanco farmacológico importante para las drogas anticoagulantes, pues la deficiencia de este cofactor previene la coagulación sanguínea (Ufer, 2005).
Modelo celular de la coagulación
Descrita por Hoffman y Monroe en 2001, explica el comportamiento in vivo de la coagulación y reemplaza la hipótesis de la cascada, dándole protagonismo a las células que participan en este proceso, las cuales son capaces de dirigir la hemostasia y a la importancia que adquiere la actividad del factor VII. Consta de tres fases, denominadas fase de iniciación, amplificación y propagación. (Hatton et al., 2013; Kumar et al., 2015). No se ahondará en este modelo, pues no es el objetivo de este trabajo.
Pruebas de coagulación
El control del paciente anticoagulado, se realiza mediante diversos exámenes hematológicos, los cuales pueden clasificarse en cuantitativas y cualitativas, dentro de las cuantitativas, encontramos:
- Recuento de plaquetas: Habitualmente se correlaciona con la tendencia hemorrágica. EL recuento normal es de 150-400.000 plaquetas/mm3 (Gomez et ál., 2021).
- Tiempo de protrombina (TP), Evalúa la función de proteínas de la vía extrínseca (Factor VII, X, V II y fibrinógeno). Se mide el tiempo en el cual tarda el tapón de fibrina en formarse. Valores normales: 10-13 segundos (dependiendo del tipo de protrombina usada y el método de detección del coágulo) (Winter et ál., 2017).
- Tiempo de Tromboplastina parcial activada (TTPa) Mide la función de las proteínas de la vía intrínseca (Factor XII, XI, IX, VIII, X, V, II y Fibrinógeno). Se registra el tiempo en el que el tapón de fibrina tarda en formarse. Su valor normal es de 25-35 segundos (Little et ál., 2017).
- Tiempo de trombina (TT): Tiempo que tarda en coagular un plasma al añadir trombina. Se puede encontrar alterado en presencia de heparina e inhibidores de formación de trombina. Su valor normal es de 12 a 19 segundos (Winter et ál., 2017).
- “International normalized ratio” (INR).
Representa la estandarización del TP. Un valor de 1 indica un nivel de coagulación equivalente a un paciente sin tratamiento de VKA. Valores superiores a este se traducen como un mayor tiempo en la formación del coagulo sanguíneo y en consecuencia mayor sangrado. El valor objetivo del INR dependerá de la indicación por la que el fármaco fue prescrito, pudiendo oscilar entre 2.5-3.5.
La terapia con VKA debe ser ajustada por el médico a cargo, con el fin de alcanzar el INR deseado (Woolcombe et ál., 2022).
- Ensayo antifactor Xa. Puede realizarse mediante fluorescencia o cromogénico. Mide la actividad del factor de la coagulación X activado. Los valores normales corresponden a 0,5-1,2UI/ml (Babin et ál., 2017).
Dentro de los estudios cualitativos, encontramos
- Tiempo de hemorragia: Utilizado para valorar el funcionalismo plaquetar, el más utilizado es la técnica de Ivy, cuyo valor normal es de 8 a 10 minutos (González Guerrero & Montoro Ronsano, 2015).
- Tromboelastograma: Valora la dinámica de la elasticidad del coágulo, utilizado para valorizar la coagulación durante la cirugía (González Guerrero & Montoro Ronsano, 2015).
Tipos de anticoagulantes orales
En la actualidad se describen tres tipos de anticoagulantes orales: dependientes de vitamina K (VKA), anticoagulantes de acción directa (ACOD), y Heparinas.
1. Antagonistas de vitamina K (AVK) o cumarínicos
Entre este tipo de fármacos se encuentra la Warfarina, Acenocumarol Fenprocumaron, todas derivadas de la hidroxicumarina, siendo sus diferencias farmacocinéticas y farmacodinámicas (Tabla 1).
Tabla 2 Diferencias farmacocinéticas entre Warfarina, Acenocumarol y Fenoprocumaron (adaptado de (Ufer, 2005).
| ANTICOAGULANTE | VOLUMEN DE DISTRIBUCIÓN (L/KG) | UNIÓN PROTEÍNAS | CONCENTRACIÓN PLASMÁTICA (UMOL/L) | CINÉTICA DE ELIMINACIÓN |
| WARFARINA | 0,08-0,13 | >99% | 15-8 | Primer orden |
| ACENOCUMAROL | 0,22-0,52 | >98% | 0.03-0.3 | Bifásico |
| FENPROCUMARON | 0,11-0,14 | >99% | 1,5-15 | Primer orden |
Inhiben la carboxilación de los factores de la coagulación vitamina K dependientes: Factor II (protrombina), VII, IX y X, además de inhibir proteína C y S. Se indican en la prevención y tratamiento de la trombosis y en otro tipo de condiciones cardiovasculares (fibrilación atrial, tromboembolismo venoso y válvula cardiaca protésica) (Conway et ál., 2017).
Monitoreo
Los niveles de VKA son monitoreados mediante el INR. El cual debe mantenerse dentro del rango terapéutico determinado por el médico tratante (Expósito, 2010). Un efecto subterapéutico ofrece poca protección contra eventos tromboembólicos y un INR (>4) incrementa el riesgo de sangrado. La variabilidad en la respuesta entre distintos individuos y por su amplia gama de interacciones con otros fármacos y alimentos hacen que se requiera un seguimiento de laboratorio frecuente (Conway et ál., 2017).
Interacciones
La Warfarina posee una elevada unión a proteínas plasmáticas, así que otras sustancias o medicamentos que compiten por el sitio de unión desplazan a la Warfarina, potenciando el efecto terapéutico de los VKA (Crader et ál., 2022). La inhibición de la expresión/actividad de las enzimas CYP450 (CYP2C9 para el enantiómero-S y CYP1A2, CYP2C19, CYP3A4 para el enantiómero-R de la Warfarina), comprometidas en su metabolismo también afectan el efecto de los VKA, por lo tanto, las concentraciones plasmáticas de AVK, pueden alterarse al ser consumidos en conjunto con fármacos que modifique la expresión o disponibilidad de CYP450, como lo son algunos fármacos antimicrobianos, antihipertensivos, antiinflamatorios, entre otros (Crader et ál., 2022; Little et ál., 2017) (Tabla 2).
Dentro de los efectos adversos que pueden presentar los pacientes bajo tratamiento con AVK, encontramos las complicaciones hemorrágicas, efectos teratogénico causando condrodisplasia e hipoplasia nasal, necrosis cutánea, reacciones alérgicas, daño hepático, nefropatía y alopecia (Patel et ál., 2022).
Tabla 3 Interacciones farmacológicas con los antagonistas de la vitamina K
| Grupo de fármacos | Aumento efecto AVK | Disminución efecto AVK |
| Antimicrobianos | Amoxicilina con ácido Clavulánico, Azitromicina, Claritromicina, Levofloxacino, Ritonavir, Tetraciclina, Ciprofloxacino, Eritromicina, Fluconazol, Isoniazida, Miconazol | Riseofulvina, Nafcilina, Ribavirina, Rifampicina, Dicloxacilina, Ritonavir |
| Cardiovasculares | Amiodarona, Diltiazem, Fenofibrato, Clofibrato, Propafenona, Propranolol, Sulfinpirazona, Aspirina | Colestiramina, Bosentán, Espironolactona |
| Antiinflamatorios e inmunomoduladores | Fenilbutazona, Interferón, Aspirina, Paracetamol, Tramadol | Mesalazina, Azatioprina |
| Sistema nervioso central | Alcohol (en caso de coexistir hepatopatía), Citalopram, Entacapona, Sertralina, Disulfiram, Hidrato de cloral, Fluvoxamina, Fenitoína, antidepresivos tricíclicos (Amitriptilina, Clomipramina), Benzodiazepinas | Barbitúricos, Carbamazepina, Clordiazepóxido. |
| Otros fármacos | Esteroides anabólicos, Zileutón, Zafirlukast, Fluorouracilo, gemcitabina, Levamisol con Fluorouracilo, Paclitaxel, Tamoxifeno, Tolterodina, Tiamazol, L-Tiroxina | Mercaptopurina, Raloxifeno, suplementos Multivitamínicos, vacunación contra la gripe, sustancias quelantes. |
2. Anticoagulantes de acción directa (ACOD)
Este tipo de anticoagulantes han ganado popularidad en los últimos años. Los ACOD se clasifican en inhibidores directos de la trombina (factor II activado) (Dabigatran) o inhibidores directos del factor X activado (Rivaroxaban, Apixaban y Edoxaban) . Son fármacos de rápida actividad cuyas principales indicaciones son la prevención del infarto agudo al miocardio en fibrilación atrial no valvular, trombrofilaxis en la cirugía de reemplazo de rodilla o cadera y para el tratamiento/prevención del tromboembolismo venoso (Adcock & Gosselin, 2015; Conway et ál., 2017).
Monitoreo.
A diferencia de los AVK, no requieren seguimiento periódico por su predictibilidad farmacocinética y farmacodinámica. Esto es ventajoso para la conveniencia y satisfacción del paciente. A pesar de ello, existen diversas situaciones en la que el clínico querría abordar el efecto preciso del anticoagulante para definir opciones de tratamiento como podría ser una situación de urgencia (ej., trauma, hemorragia, falla renal o hepática, entre otros) (Conway et ál., 2017).
Exámenes como el TTPa, PT y TT tienen poca sensibilidad y especificidad para este tipo de fármacos, y carecen de una dosis-respuesta óptima para monitorear los ACOD. Para pacientes tomando este tipo de anticoagulantes, los resultados de los exámenes mencionados deben ser interpretados de forma cualitativa para confirmar el efecto anticoagulante (Blann & Lip, 2014).
En cuanto al INR, su uso no puede recomendarse para monitorear el uso de ACOD, ya que el índice de sensibilidad internacional fue creado como un factor de corrección de tromboplastina específicamente para los VKA (Winter et ál., 2017).
Interacciones.
La farmacocinética de los inhibidores del Factor Xa puede verse afectada por inductores/ inhibidores del CYP3A4 y/o Glicoproteína-p 1.
En cuanto a Dabigatran, no se deben indicar inhibidores/inductores de la glicoproteína-p 1, por ser un sustrato específico de esta molécula (Di Minno et ál., 2017).
Informan menos reacciones adversas que los VKA (incluyendo hemorragia intra-cerebral). Se han informado alteraciones gastrointestinales con el uso de Dabigatran, por lo que sí es posible debe reemplazar su uso por otro tipo de ACOD.
3. Heparinas
Las Heparinas son polisacáridos altamente sulfatados usados como anticoagulantes mayores. Indicados principalmente como un componente en la terapia extracorpórea para mantener el flujo sanguíneo en el riñón durante diálisis y en la oxigenación cardio-pulmonar (Heparin, 2006).
En segundo lugar, se ha utilizado para prevenir/ tratar la trombosis venosa profunda, embolismo pulmonar, complicaciones isquémicas de la angina inestable entre otras. Se administra vía intravenosa o subcutánea.
Su actividad se debe a la habilidad de inhibir múltiples factores en la cascada de coagulación. Se une a la Antitrombina como un inhibidor de la proteasa sérica y apunta a factores de la coagulación como Xa y IIa.
Para optimizar su actividad anticoagulante y minimizar el riesgo de sangrado, se han sintetizado variantes de Heparina mediante fraccionamiento (Beurskens et ál., 2020).
El uso de Heparina de bajo peso molecular ofrece diferentes ventajas por sobre la Heparina sin fraccionar, como una mayor biodisponibilidad permitiendo una dosificación más predecible y menor prevalencia de efectos adversos.
Así, la Heparina de bajo peso molecular se ha convertido en el tratamiento de elección en situaciones clínicas como el tromboembolismo venoso, cirugía mayor y síndrome coronario agudo.
La Heparina sin fraccionar se mantiene indicada en la prevención de coagulación con dispositivos extracorpóreos y en pacientes con falla renal Harenberg, 2011a, 2011b; (Walenga et ál., 2011).
Monitoreo
El ensayo antifactor Xa cromogénico se considera el gold standard para pesquisar la actividad de las heparinas de bajo peso molecular. En cuanto al TTPa se ha informado que la prolongación del tiempo en este ensayo depende del reagente utilizado. Aún así, este examen no es útil en su monitoreo, ya que este tipo de Heparinas debe su efecto principalmente a la inhibición del factor Xa, mientras que la prolongación del TTPa es dependiente de la actividad de Trombina (Babin et ál., 2017; Despas et ál., 2016).
Efectos adversos.
Se informan que por su naturaleza anticoagulante el sangrado o hemorragias son de esperarse. Los sitios de hemorragia incluyen la glándula adrenal, ovarios, área retroperitoneal. Virtualmente esta complicación puede ocurrir en cualquier sitio (Despas et ál., 2016).
La trombocitopenia inducida por Heparina es una reacción seria asociada a anticuerpos que resulta en una agregación plaquetaria anormal e irreversible, llevando a eventos tromboembolicos y potencialmente mortales (Harenberg, 2011b).
Se dice que el largo uso de heparina puede causar Osteoporosis y, en consecuencia, aumentar el riesgo de fractura por la inhibición de la diferenciación osteoblástica y su función (“Heparin”, 2006).
Terapia puente/traslape
El traslape (bridging en inglés), consiste en sustituir un anticoagulante de actividad prolongada (usualmente warfarina), por uno de corta duración (usualmente Heparina de bajo peso molecular) para limitar el tiempo de los niveles anticoagulación sub terapéuticos y minimizar el riesgo tromboembólico.
A pesar de que existe evidencia que informa que su uso es limitado, sigue siendo utilizado en función de cada caso (Nazar J. et ál., 2018; Polania Gutièrrez & Rocuts, 2022).
Complicaciones
Las complicaciones que presentan los pacientes bajo tratamiento TACO, se pueden clasificar en hemorrágicas, las cuales pueden ser hemorragia menor , hemorragia mayor
y hemorragia que comprometa la vida; y no hemorrágicas, como la necrosis cutánea, embolias periféricas, alopecia y osteoporosis (Blann & Lip, 2014).
Manejo odontológico
Anamnesis. Se debe completar la ficha clínica del paciente acuciosamente, informando el motivo por el que se recetó el anticoagulante, eventos pasados de sangrado prolongado tanto como en la consulta dental como en otro contexto. Es importante constatar toda la información necesaria antes de realizar cualquier procedimiento invasivo, así el clínico posee un respaldo (Iwabuchi et ál., 2014)
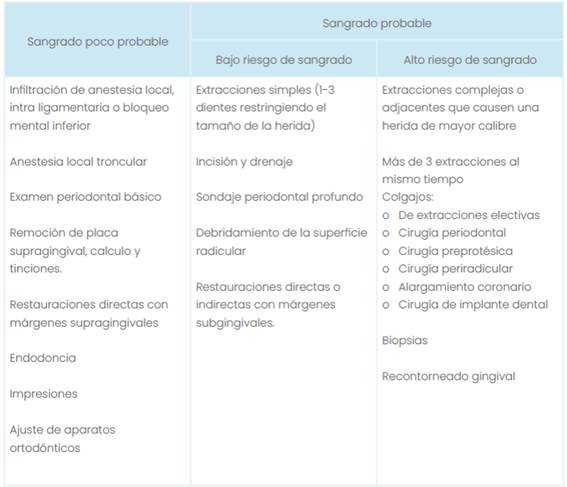
Valoración del riesgo hemorrágico. Las intervenciones odontológicas se pueden dividir en aquellas en las que es poco probable que exista sangrado y otras en los que es probable (Tabla 3). Según esta valoración es posible determinar qué procedimientos pueden o no realizarse en la consulta dental sin que existan mayores complicaciones.
Tabla 4 Valoración de riesgo de sangrado en procedimientos dentales según el “Scottish Dental Clinical Effectiveness Programme”.
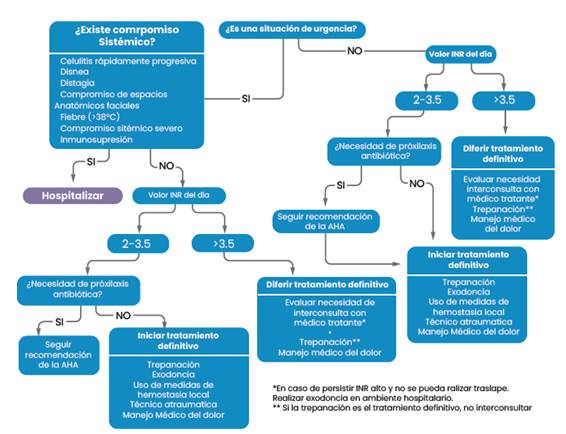
En pacientes con VKA se debe solicitar INR para determinar si es seguro o no realizar la intervención correspondiente. Este debe solicitarse con mínimo 24 horas antes del procedimiento, pero en pacientes con un INR estable es posible aceptar un INR no mayor a 72 horas (Woolcombe et al., 2022). Continuar o detener la terapia anticoagulante en este tipo de pacientes es una decisión del médico tratante y no del odontólogo. En general, la literatura informa que con valores de INR hasta 4 se pueden realizar tratamientos invasivos (siempre teniendo a mano todas las medidas de control hemorrágico posible). En caso de que el valor del INR no permita la realización del procedimiento, la trepanación puede ser una opción mientras se regularizan los exámenes del paciente, ya que es considerado un procedimiento donde es poco probable que ocurra sangrado (Calcia et ál., 2021; Winter et ál., 2017). El flujo de atención en estos pacientes se describe en la figura 2.
Para aquellos pacientes tomando ACOD no es necesario suspender la medicación, y el procedimiento puede llevarse a cabo teniendo las medidas hemostáticas pertinentes (Caliskan et ál., 2017).
En caso de pacientes con anticoagulantes inyectables como Heparina de bajo peso molecular, se debe tratar sin interrumpir la medicación. Se asume que el riesgo de sangrado en estos pacientes es dosis dependiente. En pacientes utilizando este fármaco con dosis profiláctica, el riesgo es menor que si estuviera consumiendo un VKA (Andras et ál., 2017).
Profilaxis antibiótica. El uso de antibiótico preoperatorio se ha descrito como un predictor de hemorragia postoperatoria a pesar de que el mecanismo de acción no está bien descrito. Del mismo modo, el uso de antibiótico postoperatorio ha sido informado como factor de riesgo de sangrado intraoral.
Una sola dosis antibiótica no afecta de manera significativa el PT-INR del paciente anticoagulado, pero se debe monitorear su administración en pacientes con un INR 3 por un aumento en el rango terapéutico (Huang et ál., 2022; Yamada et ál., 2020). La profilaxis antibiótica, en caso de ser necesaria deben seguirse las recomendaciones de la “American Heart Association” (Wilson et ál., 2021).
Anestesia La adrenalina provoca constricción local de los vasos sanguíneos en el sitio quirúrgico desde 20 minutos hasta 2 horas. La ocurrencia de sangrado postoperatorio se ve afectada por la adrenalina al momento de controlar el sangrado en el sillón dental y 2-3 horas posterior al procedimiento (Inokoshi et ál., 2021). Se ha informado que el bloqueo nervioso inferior puede ser un factor de riesgo para sangrado postoperatorio (Huang et ál., 2022). En general, es seguro utilizar anestésicos locales en pacientes anticoagulados, siendo un procedimiento catalogado como de bajo riesgo de sangrado (tabla 3).
Procedimiento quirúrgico. Se debe priorizar una técnica quirúrgica atraumática, evitando en medida de lo posible extender la herida (realizar solo una extracción o limitar el desbridamiento radicular a tres dientes), y fraccionar las visitas en las que se realiza el tratamiento (Woolcombe et ál., 2022).
En general, la evidencia informa que el sangrado inmediato y postoperatorio en extracciones simples con un INR menor a 3,0 es bajo (2%-3%) (Bajkin et ál., 2014).
Hemostasia. El uso y selección de las medidas de hemostasia local dependerá en gran parte del grado de complejidad de la intervención por realizar. Entre las medidas informadas en la literatura se encuentran uso de suturas, rellenos alveolares y agentes antifibrinolíticos para el control del sangrado (Iwabuchi et ál., 2014).
Las suturas y los rellenos alveolares como celulosa oxidada o gelita han sido ampliamente reconocidos como medidas hemostáticas post extracción dental.
Aún así, no todas las guías recomiendan necesariamente el uso de suturas por sobre estos rellenos alveolares por poder causar más daño al tejido perialveolar (Iwabuchi et ál., 2014).
Entre los antifibrinolíticos descritos en ensayos clínicos randomizados se encuentran el ácido tranexámico (ATX) en tabletas, enjuague e intravenoso y ácido aminocaproico épsilon AACE) en tabletas ó intravenoso . Estos agentes se unen de manera irreversible al plasminógeno y bloquean su interacción con la fibrina. El más estudiado hasta la fecha es el ATX local, cuya eficacia es limitada para prevenir el sangrado oral en pacientes anticoagulados (Engelen et ál., 2018).
Su disponibilidad como enjuague no se encuentra disponible en todos los países, por lo que soluciones inyectables son diluidas para su uso intraoral (de Vasconcellos et ál., 2017).
En cuanto a AACE, se describe como potencial antifibrinolítico en cirugía oral, pero no existen hasta la fecha ensayos clínicos aleatorizados que comparen su efecto con ATX (da Silva et ál., 2018).
La literatura informa que los ACOD tienen menos incidencia de sangrado postoperatorio que los VKA (Manfredini et ál., 2021).
Manejo del dolor. Los anticoagulantes pueden interactuar con los antiinflamatorios no esteroidales (AINES).
Se debe recomendar al paciente tomar Acetaminofen (en caso de no estar contraindicado) por sobre fármacos como Aspirina, Ibuprofeno, Diclofenaco o Naproxeno, ya que estos últimos elevan el riesgo de sangrado. Si se considera el uso de un AINES, se debe recomendar por un tiempo mínimo y con protección gástrica (Kent et ál., 2018).
Control. Se debe indicar al paciente que en caso de percibir un evento hemorrágico entre 24 horas a 7 días postintervención, debe contactarse telefónicamente con el centro donde se le intervino o dirigirse al centro en cuestión u otra facilidad que pueda controlar el sangrado (Inokoshi et ál., 2021; Rocha et ál., 2019).
Evento de sangrado postoperatorio. Definido como una hemorragia marcada luego de compresión mecánica con gaza por 30 minutos. Este tipo de eventos deben ser monitoreados desde el día del procedimiento hasta una semana después de realizada la intervención. Se sugiere que la edad, número de extracciones dentales, bloqueo nervio alveolar inferior e higiene oral son un factor de riesgo para sufrir eventos de sangrado intraoral post extracción (Huang et ál., 2022).
Conclusión
Existen múltiples protocolos para la atención del paciente anticoagulado que será sometido bajo procedimiento de cirugía oral menor.
Es importante considerar el anticoagulante utilizado, motivo, control de este, el procedimiento a realizar en el paciente y medidas hemostáticas tanto intra como postoperatorias a realizar, tras analizar lo anterior, se señala que disminuir la ingesta del fármaco para realizar el procedimiento, puede ser más perjudicial al paciente como al clínico, por lo tanto se sugiere mantener el tratamiento antitrombótico y realizar un correcto manejo médico/quirúrgico.











 texto en
texto en