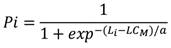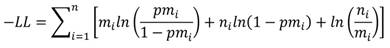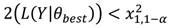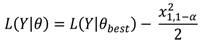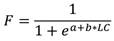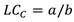Introducción
El caracol Hexaplex princeps (Broderip, 1833), representa actualmente, en el estado de Guerrero, al gasterópodo de mayor importancia en la pesca ribereña, el volumen que se captura de esta especie, es el más alto, comparado con otros gasterópodos (Castro-Mondragon et al., 2015, Castro-Mondragon et al., 2016; Cerros-Cornelio et al., 2021; Galeana-Rebolledo et al., 2018), se usa como alimento para consumo humano y por la forma de su concha, es muy apreciado para elaborar bisutería y artesanías (Flores-Garza et al., 2012; Gorrostieta-Hurtado, & Trjillo-Toledo, 2012; Gutiérrez-Zavala & Cabrera-Mancilla, 2012; Holguín-Quiñones et al., 2000). El H. princeps, forma parte de la familia Muricidae y es conocido comúnmente como “caracol chino'', se distribuye desde el Golfo de California, México hasta Perú. Alcanza una longitud de 125 mm, habita en la zona intermareal sobre rocas, se puede observar durante la marea baja extrema y mar adentro en aguas poco profundas (Keen, 1971). En el estado de Guerrero, la mayoría de las especies de moluscos que se capturan, no están sujetas a una regulación pesquera, el H. princeps no es una excepción a esta problemática. Se ha informado por Castro-Mondragón et al. (2016), que esta especie actualmente es la que sostiene la pesquería, ya que las poblaciones de sus congéneres Hexaplex radix (Swainson, 1821) y Hexaplex regius (Gmelin, 1971) se han reducido, dejando de ser redituables en la pesca ribereña. También se ha reportado, que esta especie era muy abundante en la zona submareal del arrecife de Tenacatita, Jalisco y que actualmente se ve con menos frecuencia (Landa-Jaime et al., 2013). En Puerto Ángel Oaxaca, México, H. princeps aporta alrededor del 80 % de la captura total de moluscos gasterópodos (Saito-Quezada et al., 2018).
Los estudios existentes sobre H. princeps, tratan principalmente sobre su taxonomía, ecología y pesquería (Castrejón-Ríos et al., 2015; Castro-Mondragon et al., 2015; Castro-Mondragon et al., 2016; Flores-Garza et al., 2012; Galeana-Rebolledo et al., 2018; Gutiérrez-Zavala & Cabrera-Mancilla, 2012; Molina et al., 2004; Witman et al., 2010). En cuanto a estudios sobre biología reproductiva Saito-Quezada et al. (2018), describieron el ciclo reproductivo de H. princeps en Puerto Ángel, Oaxaca, México, dando a conocer información de referencia como la temporada de desove para posibles medidas de gestión.
Por otro lado, en la pesca ribereña del estado de Guerrero, la captura de H. princeps, se realiza durante todo al año y es considerada como pesca incidental, sustentada por permisos para la extracción del ostión Striostrea prismatica (Castro-Mondragón et al., 2016; Cerros-Cornelio et al., 2021; Galeana-Rebolledo et al., 2018), además, no hay cifras oficiales de su captura, lo que impide realizar un análisis de la variabilidad de la producción anual. Sin embargo, Castro-Mondragón et al. (2016) estimaron un aproximado de 2 208 624 organismos capturados en un ciclo anual, mientras que en la Costa Grande la captura estimada es de alrededor de los 489 120 organismos por año (Cerros-Cornelio et al., 2021), no obstante, se considera que estas cifras son subestimaciones de los volúmenes reales de captura. Por otra parte, no se dispone de conocimientos biológicos pesqueros, para la elaboración de planes de manejo sustentables. En este contexto, es necesario recopilar información y realizar estudios sobre aspectos reproductivos y parámetros de crecimiento, que sirva como medidas de gestión para un manejo sostenible de la especie, es por ello que, el presente estudio, pretende contribuir al conocimiento del ciclo reproductivo, relacionar este ciclo con la temperatura superficial del agua y estimar la talla media de madurez de H. princeps, en Acapulco, Guerrero, así como, analizar la proporción de organismos, que se encuentran por encima de la talla mínima de captura en las tres regiones costeras del estado de Guerrero.
Materiales y métodos
El estado de Guerrero se encuentra en el Pacífico Tropical Mexicano, en las coordenadas 16°18'57''-18°53'16'' N & 98°00'26''-102°11'04'' W.
Para el análisis histológico, se realizaron muestreos mensuales de octubre 2016 a diciembre 2017 en Acapulco, se recolectaron de seis a 13 organismos por mes. La gónada de cada organismo se fijó en formol al 10 % y se conservaron en alcohol al 70 %. Las muestras se procesaron siguiendo el método descrito por Aguilar et al. (1996), se obtuvieron cortes de 7 µm y se tiñeron mediante la técnica de Hematoxilina-Eosina. Para la caracterización de los diferentes estadios de desarrollo gonádico, se utilizó el criterio utilizado por Avila-Poveda y Baqueiro-Cárdenas (2009), Torres-García et al. (2016), adecuado a H. princeps. La proporción sexual, se determinó utilizando el análisis de Chi-cuadrado (H 0= 1:1 Hembras-Machos), con un 95 % de confianza (Zar, 2014) y se comparó las tallas de longitud de concha entre machos y hembras usando la prueba no paramétrica de U de Mann-Whitney (95 % confianza).
Para obtener el ciclo reproductivo se calcularon las frecuencias relativas mensuales de cada estadio de desarrollo gonádico y se elaboraron gráficas de barras. Para relacionar el ciclo con la temperatura superficial del mar, los datos de temperatura se obtuvieron de NOAA-CIRES, Climate Diagnostics Center (Reynolds et al., 2002).
La talla media de madurez (LC M ), se obtuvo utilizando los organismos con actividad reproductiva y se calculó la frecuencia relativa acumulada por intervalo de longitud y se estimó la longitud promedio de madurez (L M ); esta se ajustó a un modelo utilizado por Brouwer & Griffiths (2005), con la siguiente ecuación:
dónde: Pi es la proporción de individuos maduros/el total de un tamaño dado, r es la pendiente, Li es longitud de la clase de talla i total en mm y LC M talla media de madurez y a es el ancho de la ojiva.
El modelo se ajustó a través de la maximización del logaritmo negativo de verosimilitud (-Log likelihood):
dónde: n es el número total de individuos de la clase i y m es el número de organismos maduros en la clase i.
Se estimaron los intervalos de confianza de la talla media de madurez con base en los perfiles de verosimilitud y la distribución x 2 (Venzon & Moolgavkar, 1988). El intervalo de confianza se definió como todos los valores de que satisfacen la siguiente desigualdad:
dónde: L(Y|q best ) es la log verosimilitud negativa del valor más probable de q y x 2 1,1-a es el valor de x 2 con un grado de libertad al nivel de confianza 1-a.
El intervalo de 95% de confianza para q abarca todos los valores q que son dos veces la diferencia entre la verosimilitud negativa de q y la verosimilitud negativa de la mejor estimación de q que sea menor a 3.84 (Haddon, 2011), utilizándose el siguiente estimador:
Para analizar la proporción de organismos capturados, se utilizó las biometrías de longitud concha (LC) de una base de datos de Costa Chica, levantada en 2013 y 2014, en las localidades de Playa Ventura, Casa de Piedra, La Bocana y el Faro y otra de Costa Grande, levantada en 2017, en las localidades de La Majahua, Zihuatanejo, Barra de Potosí, Playa la Barrita y Puerto Vicente Guerrero. Además, se realizaron muestreos mensuales en Acapulco de enero 2019 a marzo 2020 (Fig. 1).
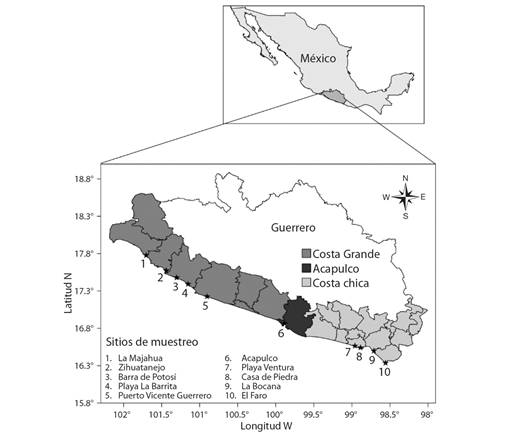
Fig. 1 Sitios de muestreo en las tres regiones del estado de Guerrero, México. / Fig. 1. Sampling sites in the three regions of the state of Guerrero, Mexico.
Para conocer los rangos de tallas de la población, se utilizó gráficos de caja y bigotes para las diferentes zonas. Para identificar diferencias en la LC entre zonas, se utilizó la prueba de bondad de ajuste para dos muestras de Kolmogorov-Smirnov (Gotelli & Ellison, 2004) utilizando el paquete estadístico IBM-SPSS Statistics 25.
La longitud de captura (LC C ) de H. princeps, se determinó utilizando los valores individuales de LC a través de la frecuencia acumulada, esta fue definida para cada zona de muestreo, obteniendo los parámetros a y b en el paquete Statistica 10. Se utilizó la función logística, cuya fórmula se expresa de la siguiente manera:
dónde: F es la fracción de individuos por intervalos de talla, a y b son constantes; y LC es la longitud de concha de los organismos.
La longitud en la cual el 50 % de la población es capturada (LC C ) se estimó de la siguiente manera:
Un análisis comparativo de la LC C y talla media de madurez (LC M ) por zona fue realizado con objetivo de observar la relación entre ambos parámetros. Además, se determinó el porcentaje de organismos que se encontraban por encima de la LC M que fue determinado para las hembras de H. princeps, con base en esto fueron definidos los organismos adultos y juveniles. Se manejó como juveniles a los organismos menores a la longitud de madurez (< LC M ) y los adultos fueron todos aquellos con talla igual o mayor a LC M (≥ LC M ), posteriormente para cada zona se definió la proporción de organismos juveniles y adultos que se están capturando en la pesca artesanal en la costa de Guerrero.
Resultados
Aspectos reproductivos: Macroscópicamente, no es posible distinguir el sexo con la estructura de la concha en el H. princeps, pero si presenta sexos separados (presencia de falo o surco ovígero). No se advirtió diferencias en la coloración de la gónada femenina y masculina, ya que, para ambos sexos, su coloración fue amarilla-blanquecina. Se logró identificar cuatro estadios gonádicos, observando el porcentaje que ocupaba en el cono hepatogonadal (gametogénesis = de 10 a 50 %; madurez = 60 a 100 %; desove/expulsión = < 10 % observándose flácida y algo traslucida y reposo = 0 %) (Fig. 2).
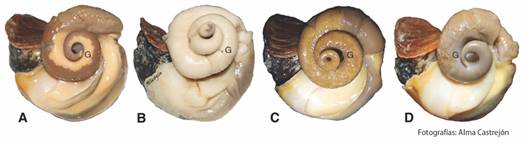
Fig. 2 Estadios de la gónada (G) de Hexaplex princeps macroscópicamente visibles. A. Gametogénesis, B. Madurez, C. Desove/expulsión y D. Reposo. / Fig. 2. Macroscopically visible stages of the gonad (G) of Hexaplex princeps. A. Gametogenesis, B. Maturity, C. Spawning/expulsion and D. Resting.
Para el ciclo reproductivo se analizaron histológicamente 145 ejemplares de H. princeps, 79 fueron hembras (54.5 %) y 66 machos (45.5 %). De acuerdo con la prueba x 2 la proporción sexual fue 1:1 (H:M) (P > 0.05) (Tabla 1). Las tallas de los especímenes analizados histológicamente, oscilaron de 47.25 a 106.75 mm de LC, con un promedio de 77 ± 12.8 mm de LC. Las hembras mostraron tallas desde 47.25 a 106.75 mm de LC, con un promedio de 76.7 ± 13.2 mm de LC, y los machos mostraron de tallas de 55.27 a 105.7 mm de LC, con un promedio de 77.4 ± 12.4 mm de LC. No se estimaron diferencias estadísticas significativas entre la longitud de conchas de hembras y machos (U de Mann Whitney = 2 541.500; P = 0.795).
Tabla 1 Proporción sexual de Hexaplex princeps calculados para la zona de Acapulco, Guerrero, México. Table 1. Sex ratio of Hexaplex princeps calculated for Acapulco, Guerrero, Mexico.
| Comparación | Hembras | Machos | Probabilidad | Proporción (H:M) |
| Octubre 2016 | 5 | 5 | 1.000 | 1:0 |
| Noviembre | 5 | 5 | 1.000 | 1:0 |
| Diciembre | 5 | 5 | 1.000 | 1:0 |
| Enero 2017 | 9 | 3 | 0.083 | 3:0 |
| Febrero | 5 | 5 | 1.000 | 1:0 |
| Marzo | 5 | 5 | 1.000 | 1:0 |
| Abril | 7 | 3 | 0.206 | 2:3 |
| Mayo | 5 | 1 | 0.102 | 5:1 |
| Junio | 5 | 3 | 0.480 | 1:7 |
| Julio | 5 | 2 | 0.257 | 2:5 |
| Agosto | 5 | 5 | 1.000 | 1:0 |
| Septiembre | 3 | 7 | 0.206 | 0:4 |
| Octubre | 7 | 6 | 0.782 | 1:2 |
| Noviembre | 4 | 7 | 0.366 | 0:6 |
| Diciembre | 5 | 3 | 0.480 | 1:7 |
| Total | 80 | 65 | 0.280 | 1:2 |
Se determinaron cinco estadios de desarrollo gonadal para ambos sexos; I) gametogénesis, II) maduro, III) desove/expulsión, IV) post-desove/post-expulsión y V) reposo (Fig. 3).
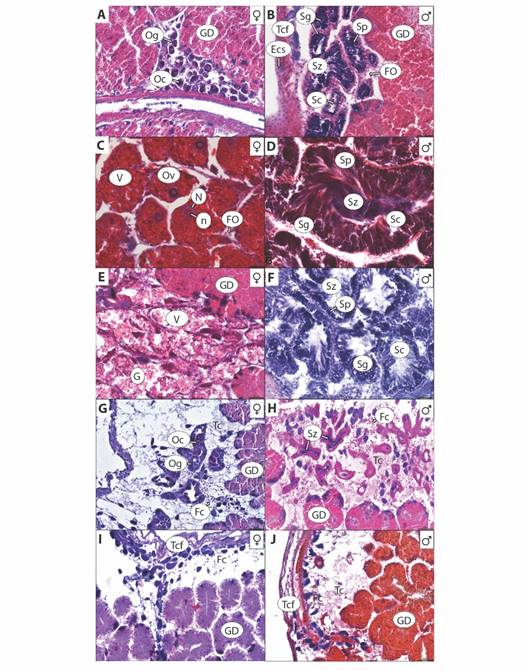
Fig. 3 Estadios de desarrollo gonádico de Hexaplex princeps: A. y B. Gametogenesis, C. y D. Maduración, E. y F. Desove/expulsión, G. y H. Post-desove/ post-expulsión e I. y J. Reposo. Glándula digestiva (GD), Gónada (G), Ovogonias (Og), Ovocitos primarios o secundarios (Oc), Tejido conectivo fibroso (Tcf), Tejido conectivo (Tc), Epitelio cúbico simple (Ecs), Foliculos (FO), Espermatogonias (Sg), Espermatocitos (Sc), Espermatidas (Sp), Espermatozoides (Sz), Ovocitos vitelogenicos (Ov), Vitelo (V), Nucleo (N), Nucleolo (n) y Fagocitos (Fc). / Fig. 3. Hexaplex princeps gonadal development stages: A. and B. Gametogenesis, C. and D. Maturation, E. and F. Spawning/expulsion, G. and H. Post-spawning/ post-expulsion and I. and J. Rest. Digestive Gland (GD), Gonad (G), Oogonia (Og), Primary or Secondary Oocytes (Oc), Fibrous Connective Tissue (Tcf), Connective Tissue (Tc), Simple Cubic Epithelium (Ecs), Follicles (FO), Spermatogonia (Sg), Spermatocytes (Sc), Spermatids (Sp), Spermatozoa (Sz), Vitelogenic oocytes (Ov), Yolk (V), Nucleus (N), Nucleolus (n) and Phagocytes (Fc).
I. Gametogénesis: Comprende el crecimiento y desarrollo celular. Formación de folículos pequeños e irregulares. Proliferación de gametogonias (ovogonias y espermatogonias) en mayor proporción. Formación de gametocitos (ovocitos primarios y secundarios en hembras, espermatocitos y espermátidas en machos). Pocos gametos maduros (ovocitos vitelogénicos en hembras y espermatozoides en machos) (Fig. 3A, Fig. 3B). En hembras este estadio se presentó de diciembre 2016 a marzo, en julio, octubre y noviembre 2017. En machos se observó en febrero (Fig. 4A, Fig. 4B).
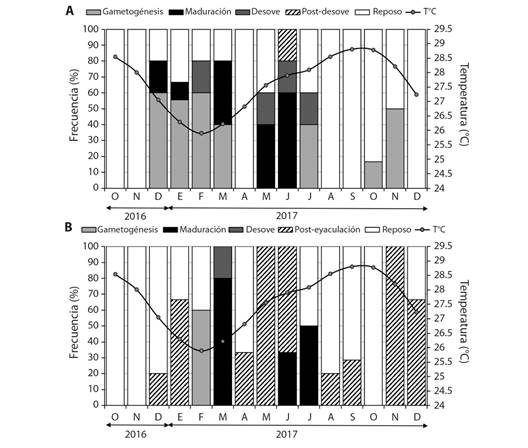
Fig. 4 Frecuencia mensual de los estadios de desarrollo gonádico y variación mensual de la temperatura A. Hembras y B. Machos de Hexaplex princeps en Acapulco, Guerrero, México. / Fig. 4. Monthly frequency of gonadal development stages and monthly temperature variation A. Females and B. Males of Hexaplex princeps in Acapulco, Guerrero, Mexico.
II. Maduro: Gónada alcanza su talla máxima y los organismos están listos para llevar a cabo la reproducción. Folículos de mayor diámetro, completos, llenos de gametos y en machos hay presencia de vasos deferentes. Dominancia en proporción de gametos maduros. Menor proporción de gametocitos. Pocas o nulas gametogonias. Lumen del saco gonadal y folículos están completamente llenos (Fig. 3C, Fig. 3D). Las hembras maduras se registraron durante diciembre 2016, enero, marzo, mayo y junio. Los machos en marzo, junio y julio (Fig. 4A, Fig. 4B). Los individuos estudiados presentaron una asincronía en cuanto a la madurez entre hembras y machos.
III. Desove o expulsión: Disminución de la gónada por liberación de gametos. Folículos completos o rotos, con espacio en el lumen debido a la liberación de ovocitos vitelogénicos y espermatozoides. Restos de ovocitos vitelogénicos, vitelo en mayor proporción en hembras. En menor proporción, los folículos contienen pocas gametogonias y gametocitos (Fig. 3E, Fig. 3F). En hembras este estadio ocurrió en febrero y de mayo a julio. En machos se registró en marzo (Fig. 4A, Fig. 4B).
IV. Post-desove o Post-expulsión: Gónada reduce su tamaño por la presencia de fagocitos. Se observan restos de tejido reticular y hay mayor presencia de tejido conectivo. La glándula digestiva comienza a recuperar espacio. Quedan restos de algunas ovogonias y ovocitos en hembras; espermatogonias, espermátidas y espermatozoides en machos (Fig. 3G, Fig. 3H). En hembras se observó en junio. En machos de enero, abril a junio, agosto, septiembre, noviembre y diciembre (Fig. 4A, Fig. 4B).
V. Reposo: Saco gonadal reducido y la glándula digestiva recupera su lugar. Baja actividad gonadal después de la liberación de gametos (inactivo o en reposo), la disminución de su actividad reproductiva permite la acumulación de nutrientes que son utilizados posteriormente en la producción de gametos. La presencia de gametos es casi nula o pocos. Fagocitos y amebocitos pocos o nulos (Fig. 3I, Fig. 3J). En hembras este estadio se presentó durante todo el periodo de estudio. En machos, se presentó en casi todos los meses, excepto en marzo, mayo, junio y noviembre de 2017 (Fig. 4A, Fig. 4B ).
La temperatura en la zona de Acapulco mostró un rango promedio de 26 a 29 °C, el inicio de la actividad reproductiva (maduración, desove/expulsión) ocurrió cuando se registró un descenso de la temperatura durante diciembre (27 °C) y este continuó hasta julio, observándose que el periodo reproductivo ocurrió entre temperaturas de 26 a 28 °C (Fig. 4).
De las 79 hembras, 15 estaban maduras las cuales presentaron rangos de longitudes entre 89.9 a 98.7 mm de LC, obteniéndose una LC M = 94.1 mm (Fig. 5A), los perfiles de verosimilitud indicaron que pueden madurar entre 89.9 y 98.7 mm de LC (Fig. 5B). De los 66 machos, 26 estuvieron maduros y mostraron rangos de longitudes de 60.83 a 105.7 mm de LC, se obtuvo una LC M = 86.1 mm de LC (Fig. 5C), los perfiles de verosimilitud indicaron que pueden madurar entre 80.1 y 92.3 mm de LC (Fig. 5D).
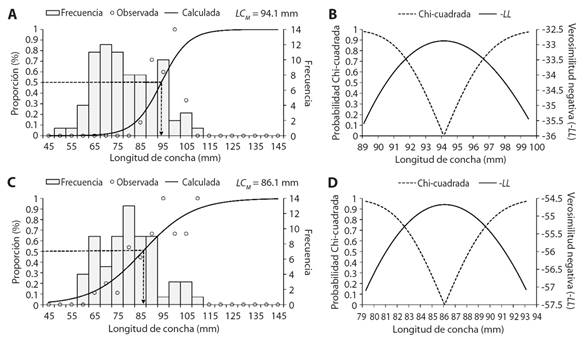
Fig. 5 Talla de maduración (LC M ) y perfiles de verosimilitud (-LL), A. y B. Hembras y C. y D. Machos de Hexaplex princeps en Acapulco, Guerrero, México. / Fig. 5. Size at maturity and likelihood profiles (-LL), A. and B. Females, and C. and D. Males of Hexaplex princeps in Acapulco, Guerrero, Mexico.
Aspectos pesqueros: Para el análisis de longitud de captura (LC C ), se utilizaron un total de 1 937 datos; 211 organismos fueron de Costa Chica con longitud de 53.37 a 127.63 mm de LC, con promedio de 83.6 ± 8.9 mm LC. De Costa Grande fueron 235 organismos con longitudes de 47.25 a 110.9 mm de LC, promedio de 82.7 ± 14.4 mm de LC. Para Acapulco, se utilizaron las biometrías de 1 491 organismos con longitudes de 32.6 a 125 mm de LC, con un promedio de 86.4 ± 12.9 mm de LC (Fig. 6). Las comparaciones de LC entre las zonas, de acuerdo con la prueba de Kolmogorov-Smirnov fueron significativamente diferentes (P < 0.05).
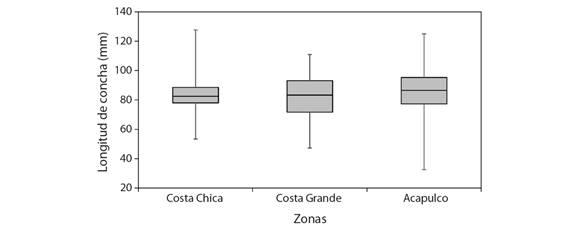
Fig. 6 Rango de tallas de los Hexaplex princeps capturados en tres zonas del estado de Guerrero, México. / Fig. 6. Size range of Hexaplex princeps captured in three areas of the state of Guerrero, Mexico.
El análisis de LC C , mostró en Costa Chica una LC C = 80.5 mm, en Costa Grande una LC C = 80.6 mm y Acapulco una LC C = 83.9 mm (Fig. 7A, Fig. 7B y Fig. 7C). Se observó que en las tres zonas la LC C estuvo por debajo de la LC M (Fig. 7).
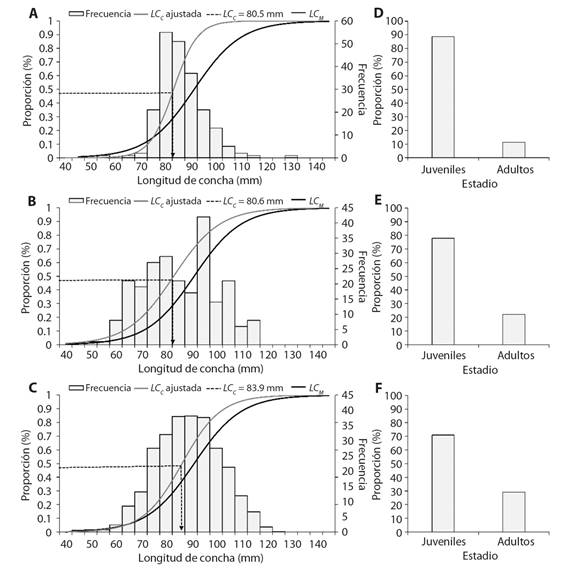
Fig. 7 Talla de captura estimada y comparación con la talla de madurez para Hexaplex princeps. Proporción de organismos juveniles y adultos capturados en tres zonas del estado de Guerrero, México, A. y D. Costa Chica, B. y E. Costa Grande y C. y F. Acapulco. / Fig. 7. Estimated capture size and comparison with the size at maturity for Hexaplex princeps. Proportion of juvenile and adult organisms captured in three areas of the state of Guerrero, Mexico, A. and D. Costa Chica, B. and E. Costa Grande and C. and F. Acapulco.
En las capturas de Costa Chica se observó un 11.4 % de organismos adultos y un 88.6 % juveniles (Fig. 7D), en Costa Grande el 22.1 % fueron adultos y el 77.9 % juveniles (Fig. 7E) y en Acapulco el 29 % adultos y el 71.1 % juveniles (Fig. 7F).
Discusión
La proporción de sexos (1:1) observada en H. princeps en este estudio, es similar a lo observado por Saito-Quezada et al. (2018) en Oaxaca México. Un comportamiento similar, en proporción sexual, fue observado para otras especies del mismo género como H. trunculus y H. nigritus (Cudney-Bueno et al., 2008; Tirado et al., 2002; Vasconcelos et al., 2008). En cuanto a la comparación de las tallas tal como el largo de machos y hembras, utilizados para el estudio histológico, no se encontraron diferencias significativas, sin embargo, Tirado et al. (2002), en H. truculus, observaron que los machos predominaron en individuos pequeños y las hembras en tallas de mayor tamaño.
El análisis histológico de los organismos de H. princeps en Acapulco, permitió caracterizar cinco estadios de desarrollo gonádico para hembras y machos. Saito-Quezada et al. (2018) determinaron seis etapas para hembras y cinco para machos en Oaxaca, México. Sin embargo, la diferencia de los estadios del ciclo gonádico se debe a que el presente estudio se basó en la caracterización descrita por Avila-Poveda & Baqueiro-Cárdenas (2009); Torres-García et al. (2016), adaptada para H. princeps de acuerdo a las observaciones de los cortes histológicos.
El periodo de mayor actividad reproductiva se presentó de diciembre a julio con una temperatura de 26 a 28 °C para la localidad de Acapulco, estos resultados coinciden con lo reportado por Saito-Quezada et al. (2018) para la zona de Puerto Ángel Oaxaca, la reproducción se dio en enero, abril y mayo, con temperaturas de 28 °C, sin embargo, también se observaron otros dos picos de actividad reproductiva durante octubre y noviembre. Por otro lado, Baqueiro-Cárdenas et al. (1983), observaron para Hexaplex erythrostomus, en Bahía Concepción, Baja California Sur, que su evento reproductivo se da de mayo a julio durante los meses más cálidos, donde la temperatura máxima del mar es de 28 °C. Para H. nigritus en la parte norte del Golfo de California, México, el periodo reproductivo se presenta en primavera y verano, con picos reproductivos en junio y julio, observando que las agregaciones reproductivas se dan entre los 22 a 31 °C (Cudney-Bueno et al., 2008). Para H. trunculus en Ria Formosa, Portugal, la temporada reproductiva se presenta de febrero a junio, con un pico de mayor actividad reproductiva en mayo y junio (Vasconcelos et al., 2004). Vasconcelos et al. (2008) definieron el periodo de desove en mayo y junio para esta misma localidad, cuando las temperaturas oscilaban entre los 26 y 29 °C. Es evidente que el periodo de mayor actividad reproductiva de las especies del género Hexaplex es estacional (primavera y verano), respondiendo a temperaturas entre 22 a 31 °C.
La talla media de madurez (LC M ) de H. princeps, es el primer reporte para toda su área de distribución. El presente estudio muestra que la LC M tiende a ser mayor en hembras que en machos, esto ha sido observado para otras especies de la familia Muricidae, como H. trunculus (Elhasni et al., 2010; Gharsallah et al., 2010) y B. brandaris en costas de Túnez (Elhasni et al., 2013), así como, para otras especies de gasterópodos tales como: Buccinum cyaenum, Strombus gigas, B. isaotakii, Odontocymbiola magellanica y Adelomelon brasiliana (Bigatti et al., 2008; Cledón et al., 2008; Chiquillo-Espítia et al., 1997; Ilano et al., 2003; Miloslavich & Dufresne, 1994). La diferencia de LC M entre machos y hembras puede deberse a un crecimiento diferencial entre los sexos (Power & Keegan, 2001). En general, los machos maduran a una talla menor porque su sistema genital es menos complejo (Giese & Pearse, 1977), su inversión reproductiva es energéticamente menos costosa (Brokordt et al., 2003), o porque las hembras ocupan maximizar su espacio disponible para los órganos y material reproductivo (Son & Hughes, 2000).
La talla de captura (LC C ), estimada en el presente estudio, para las tres zonas de Guerrero, se encuentra por debajo de la LC M y se considera que, la proporción de organismos juveniles capturados es alta, lo cual, es evidencia de la extracción de organismos que no han alcanzado su madurez sexual y esto a su vez es un indicador, de que el esfuerzo de pesca es intenso. El desconocimiento del esfuerzo de pesca sobre H. princeps en Guerrero, vuelve más complejo el conocer el estatus de su abundancia y, además, existe evidencia del efecto del intenso esfuerzo de pesca sobre especies de la familia Muricidae, los cuales han disminuido sus abundancias, como el caso de H. trunculus y B. brandaris (Marques & Oliveira, 1995).
Los especímenes analizados de H. princeps se obtuvieron de pescadores, que los capturaron por buceo libre, por lo que, se suponía una mayor selectividad hacia tallas grandes, sin embargo, los resultados demostraron lo contrario. La proporción de organismos capturados por encima de la longitud mínima de captura (LC M ) es baja. Este hecho, también fue reportado para otros murícidos, como H. trunculus y B. brandaris por Vasconcelos et al. (2008) y Elhasni et al. (2017), quienes justificaron la presencia de una proporción de organismos por debajo de la talla de madurez, como un efecto de la poca selectividad del arte de pesca, utilizado en ambos estudios (trampa y red de arrastre). Sin embargo, se considera que la selectividad de capturas de organismos comerciales en Guerrero, está en la decisión y manejo de los pescadores. También es probable que, el porcentaje capturado por encima de la longitud mínima de captura, se deba a un proceso migratorio ontogénico entre las áreas de menor y mayor profundidad, al respecto, Elhasni et al. (2017), mencionan que este fenómeno, se puede deber a una segregación migratoria, donde los organismos juveniles, se concentran en zonas menos profundas y los adultos en zonas de mayor profundidad. En Guerrero, los pescadores ribereños, tienen poca autonomía y capacidad de explorar mayores profundidades, lo cual, impactaría sobre el porcentaje de juveniles capturados.
Con los resultados obtenidos sobre el periodo reproductivo, la talla media de madurez de las hembras y la evidencia de una alta proporción de organismos capturados por debajo de esta, se podrían proponer dos medidas de manejo: 1) una veda entre diciembre y julio durante el periodo de mayor actividad reproductiva y 2) que la talla mínima de captura sea de ≥ LC M (94.1 mm) que corresponde a las hembras, dado que la LC M de la población y de los machos se estimaron con valores inferiores. Con base en esta información, se propondría otra medida de manejo: 3) estimar una cuota de captura anual (Diario Oficial de la Federación, 2018), la cual debe de ser alrededor del 40 % de los organismos accesibles a la pesca (PANGAS, 2012). Con estas acciones, se coadyuva a la conservación y manejo sustentable de este recurso, dado que, permitiría que los organismos juveniles, se reproduzcan al menos en una ocasión y que no sean extraídos de su hábitat, en el tiempo en que la mayoría de la población esté en actividad reproductiva. Debido a la problemática observada, sobre el desconocimiento biológico básico de H. princeps y las tallas capturadas en las costas de Guerrero, el presente trabajo, muestra algunos indicadores básicos para su manejo sustentable. Sin embargo, es importante generar estimaciones de abundancia para determinar el estado actual de la población, para que, en un futuro, este tipo de información pueda ser plasmada en la carta nacional pesquera y para generar un plan de manejo pesquero.
Declaración de ética: los autores declaran que todos están de acuerdo con esta publicación y que han hecho aportes que justifican su autoría; que no hay conflicto de interés de ningún tipo; y que han cumplido con todos los requisitos y procedimientos éticos y legales pertinentes. Todas las fuentes de financiamiento se detallan plena y claramente en la sección de agradecimientos. El respectivo documento legal firmado se encuentra en los archivos de la revista.












 uBio
uBio