Introducción
En el Gran Caribe se han registrado nueve especies de pastos marinos, de los cuales seis están representados en el Caribe colombiano donde la composición de las praderas está dada principalmente por Thalassia testudinum y Syringodium filiforme y, en menor proporción, por Halodule wrightii y Halophila decipiens (Gómez-López, 2011). Los pastos marinos en Colombia son ecosistemas marinos estratégicos debido a los bienes y servicios que ofrecen para la regulación del clima (reservorios de carbono), protección de la línea de costa (compactación de los sedimentos por las raíces y rizomas de las plantas) y conservación de la diversidad biológica (protección de organismos en distintas etapas de su ciclo biológico), entre otros. Numerosos estudios indican que los pastos marinos han desaparecido a nivel global a una tasa de 110 km2 por año, entre 1980 y 2006 (Waycott et al., 2009). Algunos de los tensores reconocidos en esta pérdida, que actúan independiente o sinérgicamente entre sí dependiendo de las zonas, han sido el incremento de nutrientes (Burkholder et al., 1992; Burkholder et al., 2007) y sedimentos (De Boer, 2007), introducción de especies invasoras (Williams, 2007), competencia por espacio (Heck et al., 2008), la pérdida de hábitats y presencia de enfermedades especialmente la infección producida por Labyrinthula spp. (Súper grupo Chromoalveolata, filo Labyrinthulomycota) (Sullivan et al., 2013). Este protista produce lesiones sobre las hojas de los pastos marinos a través de la degradación enzimática de la pared celular, condensación y destrucción de los cloroplastos y del citoplasma con una muy rápida diseminación por contacto entre hojas maduras, sin embargo, la severidad de la enfermedad está determinada por la virulencia del clado genético que infecte a las praderas, por el nivel de estrés al que estén sometidos los pastos por condiciones de eutrofización, luz y salinidad del agua (Waycott et al., 2009) y por los metabolitos de defensa (inducidos y constitutivos) que produzca la planta (Steele et al., 2005). En este sentido se ha reportado que los pastos marinos producen ácidos fenólicos y Thalassiolina A y B como respuesta a la infección, sin embargo, se desconoce si otros metabolitos secundarios puedan tener actividad antimicrobiana (Jensen et al., 1998; Trevathan-Tackett et al., 2015).
En Colombia, desde el 2000, se han desarrollado estudios de distribución y caracterización de los hábitats de las praderas y, desde el 2008, se iniciaron seguimientos al comportamiento de las variables indicadoras de su estado, entre las que se encuentra la presencia de Labyrinthula spp. (Gómez-López et al., 2014), dada la mortalidad que se le ha atribuido a este protista históricamente en costas del Atlántico en América y Europa, y en costas del Pacífico en Norteamérica, Japón, Australia y Nueva Zelanda (Bull et al., 2012; Porter et al., 1991; Sullivan et al., 2013). En el país han sido detectadas praderas infectadas en San Andrés, Providencia y la Guajira, sin que se haya detectado muerte de los pastos, y se han observado diferencias espacio temporales en la incidencia de la enfermedad en los monitoreos realizados por el Instituto de Investigaciones Marinas y Costeras (INVEMAR) en los últimos años (Gómez-López et al., 2014). Sin embargo, hasta ahora no se habían desarrollado estudios de la respuesta química de defensa de estas fanerógamas marinas con síntomas de la enfermedad en el Caribe Colombiano que permitan comparar con los estudios que se han desarrollado en la Florida (Loucks, 2013; Trevathan-Tackett et al., 2013), en Cuba (Hernández et al., 2015; Regalado et al., 2012; Riera-Romo et al., 2018), en México (Cruz-Sosa & Nieto 2019; García-Granados et al., 2019) y los desarrollados en Zostera marina a nivel global que han visto diezmadas también sus praderas por este endófito desde los años 30. Por lo tanto, el objetivo del presente estudio fue explorar, a través de un análisis metabolómico bajo un enfoque basado en perfilado metabólico, los cambios que se presentan entre plantas sanas e infectadas de praderas de pastos marinos expuestas a diferentes efectos antrópicos y analizar algunos parámetros epidemiológicos que permitan determinar la condición de estas praderas.
Materiales y métodos
Las muestras de vástagos (rizomas con hojas) de Thalassia testudinum fueron recolectadas por el INVEMAR (entidad de orden nacional autorizada para realizar la recolecta de especímenes biológicos en áreas de reserva natural), entre junio-noviembre de 2019. Un primer grupo de muestras se recolectaron en la bahía de Neguanje-T1 (11°19’10.61” N & 74°4’36.87” W) y bahía de Chengue-T2 (11°19’17.13” N & 74°7’35.48” W), ubicadas en el Parque Nacional Natural Tayrona, considerada un área con una fuerte influencia antrópica por el turismo que se desarrolla en el parque, e influencia por las aguas del río Magdalena en ciertas épocas del año y de aguas productivas durante la surgencia entre enero y marzo. Un segundo grupo de muestras se recolectaron en el Parque Nacional Natural Old Providence McBean Lagoon-P1 (13°21’47.93” N & 81°21’14.39” W), la cual es un área que se caracteriza por presentar menor actividad antrópica a lo largo del año, pero con una influencia fuerte de corrientes oceánicas de la región Caribe (Fig. 1).
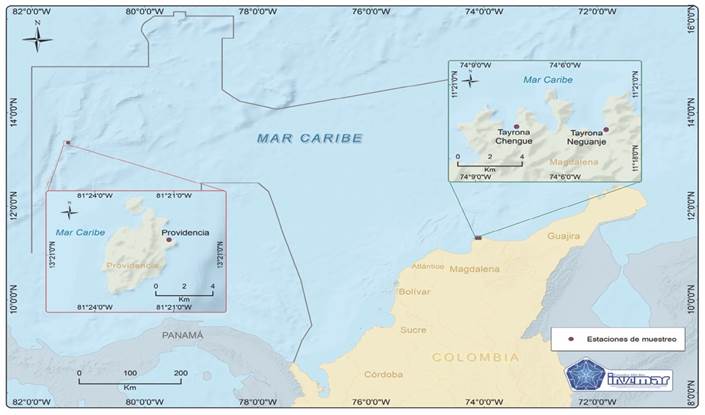
Fig. 1 Área de muestreo de T. testudinum en tres sectores del Caribe Colombiano: Isla Providencia y Parque Nacional Natural Tayrona en las bahías de Chengue y Neguanje. / Fig. 1. Sampling area of T. testudinum in three sectors of the Colombian Caribbean: Providencia Island and Tayrona National Natural Park in the Chengue and Neguanje bays.
Para la recolecta de información epidemiológica en campo y la extracción de vástagos, se realizaron dos transectos paralelos a la costa a una distancia de 0.6 m y 25 m respectivamente, y en cada uno de ellos se demarcaron 36 cuadrantes de 50 x 50 cm en las praderas. La enfermedad fue diagnosticada en las hojas por la presencia de lesiones con centros necróticos marrones oscuros que, en sus etapas iniciales, formaban líneas que se extendían hacia arriba y abajo de la hoja sólo en las áreas verdes y en etapas más avanzadas, cubrían gran parte de la misma formando una sola mancha. En cada transecto se recolectaron plantas (entre 14-20 vástagos) con hojas visualmente sanas y otras visiblemente enfermas que fueron ingresadas a la colección del Museo de Historia Natural Marina de Colombia MAKURIWA, quienes autorizaron su posterior uso para el análisis metabolómico, siguiendo los procedimientos requeridos dentro de la legislación nacional. Las plantas se preservaron después de ser lavadas con agua dulce, en bolsas con hielo hasta su procesamiento en el laboratorio, donde se eliminaron las epífitas raspando cuidadosamente con agua estéril las algas y demás material adherido, luego se lavó dos veces cada hoja y se secó con toallas absorbentes antes de secar a temperatura ambiente para el análisis de metabolitos.
Como datos epidemiológicos se estimaron para cada área: 1) la incidencia de la enfermedad, como el porcentaje de cuadrantes (50 x 50 cm) afectados por Labyrinthula spp., 2) el porcentaje de vástagos infectados por m2 calculado como el número de vástagos infectados/total de vástagos x 100, 3) la severidad de la infección, como el área total lesionada/área total de la hoja, 4) la prevalencia de la infección, como el número de hojas infectadas/número total de hojas en el vástago (que tiene entre 4-6 hojas máximo) x 100, 5) la densidad como densidad promedio de vástagos m2/% de vástagos infectados. En cada área se revisó la presencia de flores y frutos en las praderas, se caracterizó el tipo de sustrato y se estimó con base en las tablas de referencia descritas en Gómez-López et al. (2018) el indicador de condición de las praderas usando tres criterios: 1) de condición tendencia con respecto a la densidad (vástagos/m2), usado en praderas donde domina Thalassia testudinum (como en bahía de Chengue y bahía de Neguanje), 2) de condición tendencia con respecto a la densidad (vástagos/m2) de Thalassia testudinum en praderas mixtas con Syringodium filiforme (como los encontrados en Isla Providencia) y 3) de condición tendencia con respecto al porcentaje de Labyrinthula spp. presente en las praderas y la cobertura de mortalidad.
Como parámetros físico-químicos en agua se determinó la salinidad (PSU), la temperatura (°C) y el pH del agua superficial con un equipo multiparamétrico marca WTW 3630. Además, se filtraron muestras por duplicado (200 ml) por membranas de 0.45 µm para cuantificación de amonio, nitrato y ortofosfatos por técnicas colorimétricas (Strickland & Parsons, 1972). En sedimentos se cuantificó carbono orgánico total con analizador de carbono (método ISO 11464:2006, NTC 5403 método A) y materia orgánica total por método gravimétrico (Instituto Geográfico Agustín Codazzi - IGAC, 2006). Las diferencias en nutrientes entre praderas sanas y enfermas y entre áreas de estudio se estableció mediante análisis univariado a través de la prueba t-Student (al 95 % de confianza) previo análisis de normalidad de Shapiro-Wilk.
Para el análisis químico, se tomaron muestras de hojas y rizomas (por triplicado) de T. testudinum, sanas y enfermas, se secaron a 60 ºC hasta peso constante y, posteriormente, 2 g del material seco fue sometido a extracción sólido-líquido (S-L) asistida por ultrasonido (30 min x 3), utilizando como disolvente metanol grado HPLC. La mezcla resultante se separó del material vegetal por filtración simple utilizando papel filtro cuantitativo y sin cenizas (Whatman No 1). El filtrado se concentró por rota evaporación para obtener finalmente el extracto crudo. Los metabolitos presentes en estos extractos crudos se determinaron secuencialmente por tres plataformas analíticas. En un primer paso, el respectivo extracto seco (10 mg) se reconstituyó en metanol (1 ml) y se filtró en membranas de PTFE de 0.22 µm, para determinar el contenido total de fenoles (CTFe) y el contenido total de flavonoides (CTFl), utilizando 20 y 70 µl, respectivamente (vide infra). Posteriormente, se realizó el análisis por cromatografía líquida acoplada a espectrometría de masas (LC-ESI-MS), inyectando 10 µl al sistema cromatográfico (vide infra). Finalmente, 100 µl de la disolución de extracto (10 mg/ml) previamente preparada se colocó en un inserto de 200 µl, el cual se introdujo en un vial de 1.5 ml y se llevó a sequedad en un evaporador múltiple Multivapor™ P-12 (Büchi). Luego, al inserto con el extracto seco se añadieron 30 µl de una disolución de clorhidrato de metoxiamina (20 mg/ml) en piridina (Sigma-Aldrich) y se incubaron a 30 °C durante 90 min. Posteriormente, las muestras se derivatizaron con 30 µl de N-metil-N-(trimetilsilil) trifluoroacetamida (MSTFA) (Supelco) mediante incubación a 50 °C durante 30 min. Los extractos derivatizados (1 µl) fueron analizados por cromatografía de gases acoplada a espectrometría de masas (GC-MS) (vide infra).
Para la determinación del CTFe y CTFl, se siguió el protocolo previamente reportado (Buitrago et al., 2019). Para el CTFe, en un pozo de una placa de 96 pozos, se colocó la disolución del extracto (20 µl), el reactivo Folin-Ciocalteu (FC) al 10 % (40 µl) y carbonato de sodio al 7.35 % (150 µl) en cada pozo. Las mezclas se prepararon en cuatro réplicas técnicas, siendo cada pozo una réplica. La placa con las mezclas se incubó en oscuridad a temperatura ambiente durante 2 h, y luego se midió la absorbancia de las soluciones a 765 nm, en un lector de placas VarioskanTM LUX (Thermo Fisher Scientific, Waltham, MA, USA). Para el caso de CTF, en un pozo de una placa de 96 pozos, se añadió la disolución del extracto etanólico (70 µl), etanol absoluto (50 µl), tricloruro de aluminio al 10 % (10 µl) y acetato de sodio 0.1 M (10 µl). Las mezclas se prepararon en cuatro réplicas técnicas. La mezcla se dejó reaccionar durante 40 min en oscuridad y finalmente se midió su absorbancia a 420 nm en el lector de placas VarioskanTM LUX. Los valores de CTFe y CTFl se calcularon mediante una curva estándar de ácido gálico y quercetina, respectivamente. Estos contenidos totales se expresaron como mg de fenoles equivalentes a ácido gálico por gramo de material seco (mg EAG/ g MS) y mg de flavonoides equivalentes a quercetina por gramo de material seco (mg EAG/ g MS), respectivamente.
El análisis por LC-ESI-MS se llevó a cabo en un sistema cromatográfico líquido de ultra alta eficiencia (UPLC), modelo Prominence (Shimadzu, Columbia, MD, USA), equipado con un detector de arreglo de fotodiodos (DAD) y acoplado a un espectrómetro de masas LCMS2020 (con ionización por electrospray (ESI) y analizador cuadrupolar triple). La separación se hizo en una columna Kinetex® (150 × 4.6 mm, 2.6 µm), a un flujo de 0.7 ml/min, utilizando combinaciones de mezcla A (ácido fórmico al 1 % en acetonitrilo (ACN)) y mezcla B (ácido fórmico al 1 % en H2O), con un método de gradiente (0-1 min 0 % B, 1-10 min 0 % a 50 % B, 10-11 min 50 % B, 11-15 min 50 % a 100 % B, 15-17 min 100 % y 17-19 min 100 % a 0 % B). Se inyectaron 10 µl de la disolución del extracto (10 mg/ml) y se hizo el seguimiento a una longitud de onda de 270 nm. La interfaz ESI se operó simultáneamente en modo de iones positivos y negativos (bajo escaneo entre 100-2 000 m/z). La línea de desolvatación se usó a 250 °C. Se usó nitrógeno como gas nebulizador a 1.5 l/min y como gas de secado a 8 l/min. La energía del cuadrupolo se ajustó a 7.0 eV y la energía de colisión a 14 eV. La anotación de las señales se realizó después de un escrutinio detallado de los datos espectrales en el ultravioleta-visible (UV-Vis) y de espectrometría de masas en comparación con la información previamente reportada en la literatura sobre especies de T. testudinum (García-Granados et al., 2019; Hernández et al., 2015; Loucks, 2013; Regalado et al., 2012; Trevathan-Tackett et al., 2013).
El análisis por GC-MS se llevó a cabo en un cromatógrafo de gases Trace 1300 LT (Thermo Scientific, Waltham, MA, USA), equipado con un auto muestreador AI 1310, acoplado a un espectrómetro de masas Thermo ISQ (con ionización por impacto electrónico a 70 eV y un analizador cuadrupolo simple). Los metabolitos se separaron en una columna Rxi® 5 Sil MS de 60 m × 0.25 mm × 0.25 µm (Restek, State College, PA, USA) utilizando helio (99.999 %) como gas de arrastre a un flujo de 1 ml/min. Se inyectó 1 µl de muestra en modo splitless. La temperatura del puerto de inyección fue de 300 °C. El programa de temperatura comenzó con una temperatura inicial de 100 °C mantenida durante 1 min, luego aumentó de 100 °C a 250 °C a 15 °C/min y se mantuvo durante 5 min. Luego se aumentó a 310 °C a 10 °C/min y se mantuvo durante 30 min. Las temperaturas de la fuente de iones y la línea de transferencia fueron 250 °C y 310 °C, respectivamente. La anotación de las señales se realizó mediante análisis comparativo de los espectros de masas e índices de retención (IR) de los metabolitos separados y derivatizados con la base de datos Golm Metabolome (GMD) (Max- Planck Institute for Molecular Plant Physiology, Golm, Alemania), la biblioteca espectral NIST14 (Instituto Nacional de Estándares y Tecnología, Gaithersburg, MD, USA) y reportes previos en literatura (Pino & Regalado, 2010; Riera-Romo et al., 2018). Los RI de los metabolitos detectados fueron calculados utilizando una serie homóloga de n-alcanos (C8-C24), analizada a las mismas condiciones.
Los datos de CTFe y CTFl se compararon, previo supuesto de normalidad por la prueba de Shapiro-Wilks, mediante análisis paramétrico de varianza (ANOVA) y prueba de Tukey (P < 0.05) utilizando el software R versión 3.0.2 (R Core Team, 2021). Por otro lado, los archivos crudos que contenían los datos derivados de los análisis por GC-MS y LC-MS se pre-procesaron con Mzmine 2.2 (Whitehead Institute for Biomedical Research, MA, USA). En esta herramienta, se realizó la respectiva detección de señales, deconvolución, filtrado, desisotopización, llenado de espacios, alineación, normalización y auto escalado (Pluskal et al., 2010). Un total de 1 577 señales fueron filtradas para GC-MS y 99 señales para LC-MS, teniendo en cuenta su naturaleza fenólica, definida de acuerdo a bandas de absorción presentes entre 270-330 nm. De esta manera, se hizo la compilación de la lista de señales detectadas asociadas a cada metabolito separado por cada muestra evaluada, la cual se utilizó para construir el conjunto de datos de entrada. La matriz resultante (i.e., muestras versus metabolitos) se utilizó para comparar los perfiles metabólicos mediante análisis univariado a través de la prueba t (al 95 % de confianza), así como análisis multivariado por Análisis de Componentes Simultáneos-ANOVA (ASCA) y Análisis de Componentes Principales (PCA) con dos factores. Estos análisis se realizaron en la herramienta Metaboanalyst 4.0 (Chong et al., 2019).
Resultados
La mayor incidencia (15 %) y severidad (35.5 %) de la infección por Labyrinthula se observó en Providencia. Allí también se cuantificó el mayor porcentaje de vástagos infectados (22 %), aunque éstos presentaban una buena densidad, en comparación con los otros dos sitios de muestreo (Tabla 1). Las praderas de Providencia se caracterizaron por ser someras (menor a 4 metros), presentar buena visibilidad a través de observación horizontal bajo el agua y tener sedimentos gruesos con algas calcáreas y frondosas. En Providencia, los niveles de nutrientes en el agua superficial cuantificados en praderas infectadas, aunque fueron más altos que los cuantificados en praderas sanas, no presentaron diferencias significativas en la prueba t-student (T = 0.85, P = 0.48 para fosfato y T = 1.53, P = 0.26 para nitrato). Así mismo, los niveles de materia orgánica y carbono orgánico en sedimentos fueron similares entre praderas (Tabla 2).
Tabla 1 Características biológicas y variables epidemiológicas presentes en el área de muestreo. / Table 1. Biological characteristics present in the sampling area.
| Características | Providencia | Chengue | Neguanje |
| Incidencia de la enfermedad (% de cuadrantes afectados por Labyrinthula spp.) | 15 % | 10 % | 1 % |
| Severidad de la infección (total de área lesionada/área total de la hoja) en promedio obtenido en los cuadrantes | 35.8 % | 27.6 % | 0.1 % |
| Prevalencia (número de hojas infectadas/número total de hojas x 100) en valor promedio de los cuadrantes estudiados | 4 % | 4 % | 0.1 % |
| Densidad promedio de vástagos m2/% de vástagos infectados | 293 vástagos/22 % | 170 vástagos/13 % | 188 vástagos/0.6 % |
| Fenología | No se registran flores o frutos | No se registran flores o frutos | Presencia de flores |
| Indicador de condición tendencia de los pastos marinos (ICTpm) | Densidad de vástagos: Deseable Labyrinthula spp.: Deseable | Densidad de vástagos: Alerta Labyrinthula spp.: Deseable | Densidad de vástagos: Regular Labyrinthula spp.: Deseable |
Tabla 2 Características físico-químicas presentes en agua y sedimento en ambas áreas de muestreo. Datos climatológicos tomados del Centro de Investigaciones Oceanográficas e Hidrográficas de Colombia (CIOH). / Table 2. Physical-chemical characteristics present in water and sediment in both sampling areas. Climatological data taken from the Center for Oceanographic and Hydrographic Research of Colombia (CIOH).
| Localización del área de muestreo | Providencia (P1) | Chengue (T2) | Neguanje (T1) | |||
| Parámetros | PLa | PSb | PLa | PSb | PLa | |
| Profundidad de la pradera (m) | 0.95 | 0.95 | 1.4 | 1.4 | 0.8 | |
| Visibilidad horizontal bajo el agua (m) | 7 | 7 | 3 | 3 | 0.7 | |
| Precipitación promedio en el área (mes de muestreo) | 230 mm (septiembre) | 43 mm (noviembre) | 61 mm (junio) | |||
| Amonio (µg N/L) | 6 ± 3.4 | 3.1 ± 0 | 3.1 ± 0 | 3.1 ± 0 | NDc | |
| Nitrato (µg N/l) | 30 ± 9.7 | 19.4 ± 1.0 | 27.6 ± 3.2 | 24.1 ± 1.6 | NDc | |
| Ortofosfato (µg P-PO4/l) | 9.2 ± 6.8 | 5.1 ± 0.7 | 4.9 ± 3.6 | 5.2 ± 3.2 | NDc | |
| Temperatura (˚C) | 27.5 | 28 | 28.5 | 28.5 | 29.2 | |
| Salinidad PSU | 35.1 | 35.5 | 35.2 | 35.2 | 36 | |
| pH | 8.32 | 8.32 | 7.93 | 8.32 | 8.14 | |
| Carbono orgánico total (% peso seco) | 0.4 | 0.8 | 1.14 | 0.11 | NDc | |
| Materia orgánica volátil (mg/g p.s) | 223 | 278 | 52 | 48.3 | NDc | |
aPL = Pastos con Labyrinthula spp.; bPS = Pastos sanos. cND = No determinado. / aPL = Seagrass with Labyrinthula spp.; bPS = Healthy seagrass. cND = Undetermined.
En el área de Chengue se observó disminución en la incidencia (10 %) y severidad (27.6 %) de la enfermedad, así como del porcentaje de vástagos infectados (13 %), aunque la prevalencia de la infección fue igual a la cuantificada para Providencia (4 %). En Chengue se observó un mayor nivel de carbono orgánico (1.14 %) en áreas de praderas enfermas, similaridad en los niveles de materia orgánica entre praderas y no se observaron diferencias significativas en los niveles de nutrientes en agua (T = 1.38, P = 0.3 para nitrato y T = 0.08, P = 0.93 para fosfato). Estos parámetros fueron similares a los cuantificados para el área de Providencia, excepto la materia orgánica que fue muy baja en Chengue (52 mg/g) en comparación a la cuantificada en Providencia (hasta 278 mg/g).
El área de Neguanje fue la que presentó los menores índices de incidencia (1 %), severidad (0.1 %) y número de vástagos infectados (0.6 %), que incluso hizo difícil la detección de plantas con síntomas de la enfermedad, por lo cual no se hace diferencia en la Tabla 2 entre praderas sanas y enfermas. Estas praderas son someras, con baja visibilidad dada por la presencia de mucho material particulado, especialmente en la zona cercana a la costa, no tienen afluentes de ríos cercanos y se encuentran asociadas a manglares de borde sobre sedimentos de arena muy fina y limo a diferencia de los anteriores. En esta área no fue posible cuantificar los nutrientes en agua, ni carbono y materia orgánica en sedimentos.
Los resultados en general indican que las praderas de los tres sectores se encontraban en condiciones similares de salinidad, temperatura y pH. No se detectaron diferencias significativas entre los nutrientes de las aguas superficiales entre praderas sanas y enfermas de Chengue o de Providencia, ni entre las praderas de ambos sectores (T = 0.256, P = 0.8 para nitrato; T= -0.76, P = 0.47 para fosfato). El índice de condición determinado para las praderas de las tres áreas de muestreo las ubica en el rango de DESEABLES en cuanto a la infección ocasionada por Labyrinthula, sin embargo, se genera una ALERTA en la bahía de Chengue, debido al bajo número de vástagos encontrados, en comparación con Neguanje, donde su indicador es REGULAR y Providencia donde su indicador es BUENO (Tabla 2).
Por otro lado, los materiales recolectados en los tres lugares mostraron algunas diferencias, pero también similitudes en niveles de fenoles (CTFe) y flavonoides (CTFl) (Fig. 2). En este sentido, los valores significativamente más altos (P > 0.05) de CTFe y CTFl se encontraron en las plantas sanas recolectadas en Providencia (P) y Chengue (T2) (> 78 mg EAG/g MS y > 50 mg EQ/g MS, respectivamente), mientras los niveles más bajos estuvieron en los rizomas infectados en Neguanje (T1) (< 12 mg EAG/g MS y < 3 mg EQ/g MS, respectivamente). De forma general se observa una tendencia entre los órganos, dado que el contenido de estos metabolitos fue significativamente menor (P < 0.05) en rizomas que, en hojas, a excepción de las muestras sanas de T1 e infectadas de T2, cuyos niveles de fenoles y flavonoides entre hojas y rizomas no presentaron diferencias significativas. Un resultado similar se obtuvo con las muestras infectadas de Providencia, pero solo para el caso del CTFl. Particularmente, los CTFe y CTFl de hojas sanas de Neguanje no mostraron diferencias significativas con los rizomas de plantas recolectadas de los tres lugares. Por último, se observó una tendencia más generalizada al comparar los materiales vegetales sanos e infectados, dado que, sin importar el lugar o la parte vegetal implicada, las plantas sanas mostraron niveles significativamente más altos que los materiales recolectados en praderas infectadas.
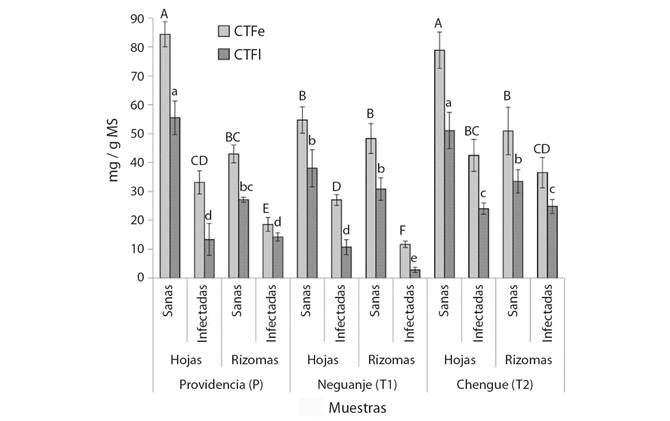
Fig. 2 Contenidos totales de fenoles y flavonoides de material vegetal de T. testudinum recolectado en tres áreas de muestreo (P = Providencia, T1 = bahía de Neguanje, T2 = bahía de Chengue), correspondiente a hojas y rizomas en plantas sanas e infectadas. CTFe = Contenido total de fenoles, expresado como mg de fenoles equivalentes a ácido gálico por gramo de material seco (mg EAG/g MS). CTFl = Contenido total de fenoles, expresado como mg de fenoles equivalentes a quercetina por gramo de material seco (mg EQ/g MS). Los valores de CTFe y CTFl se muestran a manera de barras, los cuales corresponden a los promedios ± desviación estándar (N = 3). Las distintas letras en mayúscula y en minúscula sobre las barras, indican diferencias estadísticamente significativas en los valores de CTFe y CTFl, respectivamente, de acuerdo al test de Tukey (P < 0.05). / Fig. 2. Total phenol and flavonoid contents of T. testudinum plant material collected in three sampling areas (P = Providencia, T1 = Neguanje bay, T2 = Chengue bay), corresponding to leaves and rhizomes in healthy plants and infected. CTFe = Total phenol content, expressed as mg of phenols equivalent to gallic acid per gram of dry material (mg EAG / g DM). CTFl = Total phenol content, expressed as mg of phenols equivalent to quercetin per gram of dry material (mg EQ / g DM). The CTFe and CTFl values -are shown as bars, which correspond to the means ± standard deviation (N = 3). The different uppercase and lowercase letters on the bars indicate statistically significant differences in the CTFe and CTFl values, respectively, according to the Tukey test (P < 0.05).
La caracterización química de los extractos etanólicos de los materiales vegetales recolectados de T. testudinum fue extendida mediante análisis por GC-MS y LC-MS. Esta extensión se llevó a cabo con el propósito de establecer las variaciones particulares de la mayor cantidad posible de metabolitos detectados, pero exploradas desde una perspectiva holística mediante comparación de los perfiles metabólicos obtenidos, partiendo de una matriz de entrada, ‘observaciones (i.e., muestras) × variables (i.e., intensidad de las señales de los metabolitos)’, normalizada y centrada en la media. Tal comparación inició con un Análisis de Componentes Simultáneos-ANOVA (ASCA) para definir qué tan cambiantes eran los perfiles y así identificar los principales patrones asociados con cada factor utilizado (i.e., órgano, condición, lugar). El ASCA es una extensión multivariada del enfoque univariado ANOVA que, a través de la comparación de los puntajes (scores) obtenidos por el análisis de componentes simultáneos (SCA), define las variaciones de los perfiles metabólicos dependiente de los factores, dado que la variación total del conjunto de datos se puede separar en secciones ortogonales entre sí, las cuales corresponden a los factores per se (Smilde et al., 2005). De esta manera, se revelaron variaciones dependientes de la interacción entre parte vegetal-condición de la planta [i.e., hojas (H) y rizomas (R) sanos (S) o infectados (I)] y lugar (P, T1, T2) (Fig. 3). De hecho, los cambios observados fueron distintos a razón de la plataforma analítica utilizada, ya que el análisis por GC-MS, bajo derivatización por sililación, se orientó a la detección de metabolitos primarios (ejemplo, ácidos orgánicos, lípidos y azúcares), mientras que las condiciones de análisis por LC-MS se enfocaron a la detección de metabolitos secundarios (ejemplo, fenoles y flavonoides), siendo mayor la varianza explicada para los perfiles obtenidos por LC-MS (88.51 %) que en los perfiles obtenidos por GC-MS (67.94 %). Dado este contexto, en cuanto a los perfiles de metabolitos registrados por LC-MS, se encontraron altas variaciones entre órganos de la planta y condiciones de los tres lugares de muestreo (Fig. 3A), especialmente entre Providencia (P) y Chengue (T2), excepto rizomas infectados en Neguanje (T1) y Chengue (T2), mientras que los perfiles obtenidos por GC-MS (Fig. 3B) mostraron cambios menos evidentes, especialmente entre Providencia (P) y Chengue (T2) entre órganos y condiciones, excepto los rizomas infectados en Neguanje (T1), cuya variación en puntajes resultó ser grande respecto a Providencia (P) y Chengue (T2).
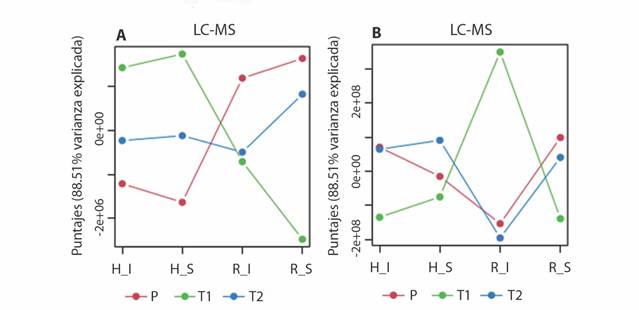
Fig. 3 Patrones principales en la variación metabólica asociados con la interacción entre los factores parte vegetal - condición de la planta [hojas (H) y rizomas (R), sanos (S) o infectados (I)] y lugar [Providencia (P), bahía de Neguanje (T1), bahía de Chengue (T2)], resultado del Análisis de Componentes Simultáneos-ANOVA (ASCA) de los perfiles obtenidos con el análisis por A. LC-MS y B. GC-MS de las muestras de T. testudinum. / Fig. 3. Main patterns in metabolic variation associated with the interaction between the plant part - plant condition factors [leaves (H) and rhizomes (R), healthy (S) or infected (I) and place [Providencia (P), Neguanje bay (T1), Chengue bay (T2)], result of Simultaneous Component Analysis-ANOVA (ASCA) of the profiles obtained with the analysis by A. LC-MS and B. GC-MS of T. testudinum samples.
Dada la evidencia de una alta variación entre los perfiles de hojas y rizomas, el análisis subsecuente se orientó a evaluar los cambios metabólicos entre plantas sanas e infectadas recolectadas en los tres lugares, separando los datos en dos grupos correspondientes a cada parte vegetal involucrada. De esta forma, mediante el diagrama de dispersión en tres dimensiones (3D) (Fig. 4A, Fig 4A-1 y Fig. 4A-2) obtenido a partir de un análisis de componentes principales (PCA) de dos factores (‘condición × lugar’), se observó que efectivamente los perfiles obtenidos por LC-MS de los materiales vegetales recolectados son diferentes dependiendo del lugar de muestreo, tanto para hojas como para rizomas. No obstante, se encontró también que los materiales sanos tenían mayores diferencias en sus perfiles metabólicos en comparación con los infectados, de tal manera que estos últimos se agruparon con una mayor cercanía en los diagramas de dispersión 3D. Estos diagramas resultaron específicamente en un 91.9 % de la varianza explicada para los perfiles de las hojas y un 88.0 % para los de rizomas, indicando una razonable explicación de la variabilidad del grupo de datos la cual es dependiente de los dos factores.
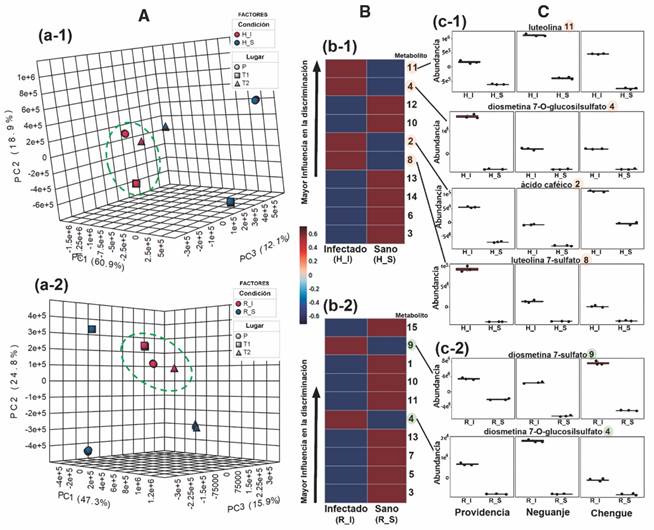
Fig. 4 Análisis comparativo de los perfiles de metabolitos obtenidos por LC-MS de T. testudinum recolectados en diferentes lugares [Providencia (P), bahía de Neguanje (T1), bahía de Chengue (T2)] y entre tejidos sanos (S) e infectados (I) de hojas y rizomas. A. Diagramas de dispersión en tres dimensiones (componente principal (PC1, PC2, PC3) derivado del análisis de componentes principales (PCA) de dos factores (‘condición × lugar’) para A-1. hojas y A-2. rizomas. Las elipses verdes con líneas discontinuas muestran las agrupaciones de las plantas infectadas (rojo). B. Mapas de calor clasificatorios de los diez (10) metabolitos más contrastantes en sus abundancias relativas (según escala de color: mayor abundancia = 0.6 (vinotinto); menor abundancia = -0.6 (azul oscuro)], de acuerdo a la prueba t (a un nivel del 95 % de confianza), entre tejidos sanos (S) e infectados (I) para B-1. hojas y B-2. rizomas. La clasificación en los mapas de calor está dada en orden descendente de acuerdo a los menores valores de P y de la tasa de falsos descubrimientos (FDR). Los números en negrita, al costado derecho de los mapas, corresponden a los metabolitos mejor clasificados, listados en la Tabla 3. C. Diagramas de cajas para las abundancias relativas normalizadas de los metabolitos más contrastantes con mayor influencia en la discriminación de tejidos infectados de C-1. hojas y C-2. rizomas, diferenciando lugar y condición. / Fig. 4. Comparative analysis of the metabolite profiles obtained by LC-MS of T. testudinum collected in different places [Providencia (P), Neguanje bay (T1), Chengue bay (T2)] and from healthy (S) and infected (I) leaves and rhizomes tissues. A. Three-dimensional scatter diagrams (principal component (PC1, PC2, PC3) derived from principal component analysis (PCA) of two factors (‘condition × place’) for A-1. leaves and A-2. rhizomes. Green ellipses with dashed lines show the clusters of infected plants (red). B. Classifying heat maps of the ten (10) most contrasting metabolites in their relative abundances (according to color scale: highest abundance = 0.6 (red wine); lower abundance = -0.6 (dark blue)], according to the t test (at a 95 % confidence level), between healthy (S) and infected (I) tissues for B-1. leaves and B-2. rhizomes. The classification in the heat maps is given in descending order according to the lowest values of P and the false discovery rate (FDR). The numbers in bold, on the right side of the maps, correspond to the best classified metabolites, listed in Table 6. C. Box plots for the relative abundances normalized of the most contrasting metabolites with the greatest influence on the discrimination of infected tissues of C-1. leaves and C-2. rhizomes, differentiating place and condition.
Para revelar aquellos metabolitos responsables de la discriminación global entre plantas infectadas y sanas, se ejecutó una prueba t (95 % de confianza) sobre las abundancias relativas de los metabolitos detectados por LC-MS en modo negativo entre estos dos grupos de datos (sin discriminar lugares), el cual permitió clasificarlos de acuerdo a esa influencia. Por tanto, los 10 metabolitos mejor categorizados, tanto para hojas como para rizomas, de acuerdo a los cambios relativos significativamente más contrastantes, fueron evidenciados mediante un mapa de calor (Fig. 4B, Fig. 4B-1 y Fig. 4B-2, respectivamente). Esta clasificación, cuyo orden descendente está de acuerdo al menor valor de P y al menor valor de la tasa de falsos descubrimientos (FDR), permitió establecer que, en conjunto, 15 compuestos estuvieron dentro de los metabolitos que mostraron cambios significativos entre plantas sanas e infectadas. Estos metabolitos mejor clasificados están listados en la Tabla 3, cuya identificación se realizó mediante el análisis de los datos obtenidos por espectrometría de masas. De estos 15 metabolitos, cinco fueron particulares para hojas (2, 6, 8, 12, y 14) y otros cinco para rizomas (1, 5, 7, 9, y 15). Además, cuatro metabolitos se compartieron para hojas y rizomas (3, 4, 10, y 13), y uno de ellos (11) mostró niveles más altos en hojas de plantas infectadas en comparación con las hojas sanas, mientras que los rizomas sanos mostraron mayores niveles comparados con los infectados.
Tabla 3 Metabolitos clasificados con la mayor influencia (por la prueba t, α = 0.05) en la discriminación entre las hojas y rizomas de T. testudinum provenientes de praderas sanas e infectadas. / Table 3. Metabolites classified with the greatest influence (by the t test, α = 0.05) in the discrimination between leaves and rhizomes of T. testudinum from healthy and infected meadows.
| #a | tR (min) | [M-H]-(m/z)b | Fragmentos (m/z)c | Fórmula moleculard | Nombree | Aumento | ||
|---|---|---|---|---|---|---|---|---|
| Sf | If | |||||||
| 1 | 9.9 | 163.1 | 105 | C9H8O3 | ácido cumárico | R | ||
| 2 | 11.6 | 179.1 | 121 | C10H10O4 | ácido caféico | H | ||
| 3 | 12.2 | 193.0 | 135 | C9H8O4 | ácido ferúlico | H, R | ||
| 4 | 14.9 | 541.1 | 419, 299, 151 | C22H22O14S | diosmetina 7-O-glucosilsulfato | H, R | ||
| 5 | 15.9 | 555.1 | 419, 313, 165 | C23H24O14S | 3’,4’-O-dimetil luteolin 7-glucosilsulfato | R | ||
| 6 | 17.2 | 445.1 | 339, 283, 135 | C22H22O10 | acacetina 7-glucósido | H | ||
| 7 | 17.3 | 461.1 | 339, 299, 151 | C22H22O11 | diosmetina 7-glucósido | R | ||
| 8 | 20.2 | 365.0 | 285, 255, 137 | C15H10O9S | luteolina 7-sulfato | H | ||
| 9 | 21.3 | 379.0 | 299, 255, 151 | C16H12O9S | diosmetina 7-sulfato | R | ||
| 10 | 22.4 | 393.0 | 313, 255, 165 | C17H14O9S | 3’,4’-O-dimetilluteolin 7-sulfato | H,R | ||
| 11 | 25.1 | 285.1 | 177, 137 | C15H10O6 | Luteolina | R | H | |
| 12 | 26.1 | 287.0 | 179, 137 | C15H12O6 | Eriodictiol | H | ||
| 13 | 26.6 | 269.0 | 177, 121 | C15H10O5 | Apigenin | H, R | ||
| 14 | 29.5 | 271.1 | 179, 121 | C15H12O5 | Naringenina | H | ||
| 15 | 29.8 | 299.0 | 177, 151 | C16H12O6 | Diosmetina | R | ||
a La numeración está dada de acuerdo al orden de aparición en los perfiles metabólicos de acuerdo al tR (= tiempo de retención cromatográfico dado en minutos). bValor de relación masa carga (m/z) para el ion quasimolecular [M-H]- obtenido en modo negativo. cFragmentos relevantes para la caracterización, observados en el espectro de masas obtenidos a 7.0 y 14.0 eV como energías del cuadrupolo y de colisión, respectivamente. dFórmula molecular del compuesto sin ionizar. eNombre del metabolito identificado de acuerdo a la información de espectrometría de masas. fParte de la planta (H = hojas; R = rizomas) en el que el metabolito tuvo un aumento significativo (P < 0.05) de acuerdo al t-test, en la abundancia relativa para planta sanas (S) o infectadas (I), según cada caso. / a The numbering is given according to the order of appearance in the metabolic profiles according to tR (= chromatographic retention time given in minutes). b Value of mass to charge ratio (m/z) for the quasimolecular ion [M-H]- obtained in negative mode. c Relevant fragments for the characterization, observed in the mass spectrum obtained at 7.0 and 14.0 eV as quadrupole and collision energies, respectively. d Molecular formula of the non-ionized compound. e Name of the identified metabolite according to mass spectrometry information. f Part of the plant (H = leaves; R = rhizomes) in which the metabolite had a significant increase (P < 0.05) according to the t-test, in the relative abundance for healthy (S) or infected (I) plants, according to each case.
Los metabolitos con mayor influencia en la separación de los perfiles para hojas infectadas fueron la luteolina (11), dioesmetina 7-O-glucosilsulfato (4), ácido cafeico (2) y luteolina 7-sulfato (8), cuyas variaciones fueron importantes y consistentes para todos los lugares, aunque con algunas diferencias en los cambios relativos para cada lugar (Fig. 4C, Fig. 4C-1). Para el caso de los rizomas infectados, los metabolitos más contrastantes fueron específicamente la diosmetina 7-sulfato (9) y también la dioesmetina 7-O-glucosilsulfato (4), con variaciones consistentes, pero con diferencias dependientes del lugar de muestreo (Fig. 4C, Fig. 4C-2). Lo anterior sugirió que 5 compuestos de naturaleza fenólica son los metabolitos que se acumulan significativamente en hojas y rizomas (dependiendo del metabolito) en plantas de T. testudinum infectadas, mientras que los demás siguen el comportamiento observado en las cuantificaciones totales de CTFe y CTFl, dónde los mayores valores se manifiestan para las plantas sanas y hay una reducción apreciable para las plantas infectadas.
En cuanto a las variaciones en los perfiles obtenidos mediante análisis por GC-MS, los datos mostraron un comportamiento diferente a lo percibido en la comparación de los perfiles derivados de LC-MS, previamente apreciado en la Fig. 3, dado que los diagramas de dispersión 3D (Fig. 5A, Fig. 5A-1 y Fig. 5A-2), resultante del PCA con dos factores (‘condición × lugar’), indicaron que los perfiles presentaban diferencias más notorias dependiendo del lugar, tanto para plantas sanas como infectadas. No obstante, el impacto de las condiciones del lugar de muestreo sobre los perfiles de las plantas infectadas fue más pronunciada, dado que estas muestras se localizaron en octantes diferentes de los diagramas de dispersión, y las plantas sanas de Providencia (P) y Neguanje (T1) exhibieron la mayor similitud, como se notó en la Fig. 3. La varianza explicada para los perfiles de las hojas fue del 91.9 %, mientras que los rizomas mostraron un 94.5 %, indicando que la variabilidad del grupo de datos está bien explicada bajo la dependencia de ambos factores.
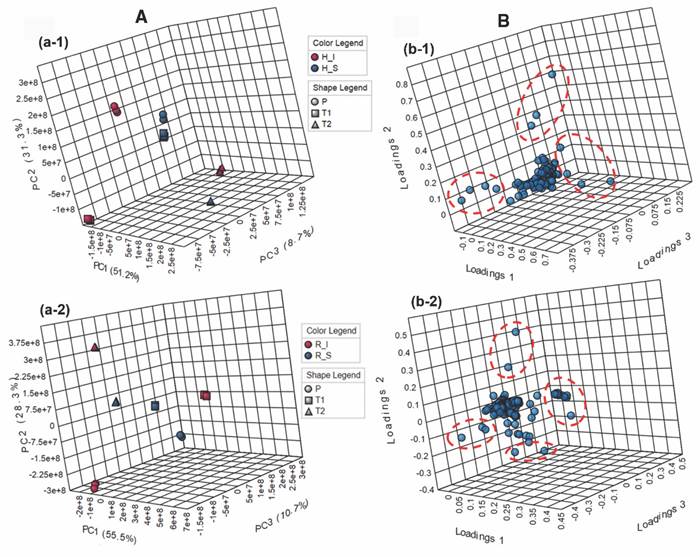
Fig. 5 Análisis comparativo de los perfiles de metabolitos obtenidos por GC-MS de T. testudinum recolectados en diferentes lugares [Providencia (P), bahía de Neguanje (T1), bahía de Chengue (T2)], de tejidos sanos (S) e infectados (I) de hojas (H) y rizomas (R). A. Diagramas de dispersión en tres dimensiones (componente principal (PC1, PC2, PC3) derivado del análisis de componentes principales (PCA) de dos factores (‘condición × lugar’) para A-1. hojas y A-2. rizomas. B. Diagramas de cargas en tres dimensiones (PC1, PC2, PC3) derivado del análisis de componentes principales (PCA) de dos factores (‘condición × lugar’) para B-1. hojas y B-2. rizomas. Las elipses rojas con líneas discontinuas muestran los metabolitos con mayor influencia en la discriminación (presentados en la Tabla 4), verificados mediante análisis de puntajes VIP (influencia de la variable en la proyección). / Fig. 5. Comparative analysis of the metabolite profiles obtained by GC-MS of T. testudinum collected in different places [Providencia (P), Neguanje bay (T1), Chengue bay (T2)], from healthy (S) and infected (I) leaves (H) and rhizomes (R) tissues. A. Three-dimensional scatter diagrams (principal component (PC1, PC2, PC3) derived from principal component analysis (PCA) of two factors (‘condition × location’) for A-1. leaves and A-2. rhizomes. B. Three-dimensional load diagrams (PC1, PC2, PC3) derived from the principal component analysis (PCA) of two factors (‘condition × place’) for B-1. leaves and B-2. rhizomes. The red ellipses with dashed lines show the metabolites with the greatest influence on discrimination (presented in Table 4), verified by VIP score analysis (influence of the variable on the projection).
La variación pronunciada dependiendo del lugar de muestreo y condición permitió establecer los metabolitos con mayor influencia en la discriminación a partir de un diagrama de cargas 3D para muestras de hojas y rizomas (Fig. 5B, Fig. 5B-1 y Fig. 5B-2, respectivamente). Por consiguiente, tales diagramas evidenciaron una mayor cantidad de metabolitos con mayor influencia en la discriminación para rizomas (20) que para hojas (11), lo cual fue contrario a lo observado en LC-MS. Los metabolitos identificados que tuvieron la mayor influencia en la discriminación se presentan en la Tabla 4.
Tabla 4 Metabolitos con mayor influencia en la discriminación de hojas y rizomas de plantas sanas y con síntomas de enfermedad en cada una de las praderas de T. testudinum. / Table 4. Metabolites with the greatest influence on the discrimination of leaves and rhizomes of healthy plants with disease symptoms in each of the T. testudinum meadows.
| Muestra | Providencia (P) | Neguanje (T1) | Chengue (T2) |
| Hojas planta sana | ribono-1,4-lactona (25), ácido 3-deshidroshiquímico (10), ácido cafeico (10) | xilosilglucosa (27) ácido 3-oxobutanóico (18), sucrosa (12) | ácido- 3-oxobutanóico (10), ácido 3-deshidroshiquímico (9) xilosilglucosa (7), sucrosa (7) |
| Hojas planta infectada | 3-hidroxi-2-isopentanona (10), sitosterol (5) | 3-hidroxi-2-isopentanona (5) sitosterol (5) | 3-hidroxi-2-isopentanona (16), glucosa (10), sitosterol (8) estigmasterol (8) |
| Rizoma planta sana | talosa (20), glicerol (9), ácido 3-oxobutanoico (9) | 1,5-anhidrosorbitol (10) talosa (10), tagalosa (10), galactosa (10), allosa (10), mioinositol (10), ribosa (10), manosa (10), xilosa (10), mioinositol (10), glicerol (10), ribosa (10), ácido arabinónico (10), alcohol alílico (10). | glicerol (12), talosa (6) |
| Rizoma planta infectada | glucosa (15), 2,6-dimetilbenzenotiol (12), 2-feniletanotiol (5), isopent-3-en-2-ona (5), 4-acetil-1-metilciclohexeno (5). | isopent-3-en 2-ona (7), 2-feniletanotiol (7), 2,6-dimetilbenzenetiol (6), glucosa (4), ácido octadecatrienoico (4) | glucosa (16), isopent-3-en-2-ona (14), ácido isopentanóico (14), acetato de octadecilo (10) |
Compuestos únicos en la muestra en negrilla. Puntajes de influencia de la variable en la proyección (VIP) de la señal del compuesto entre paréntesis. / Unique compounds in the sample in bold. Variable influence on projection (VIP) scores of the composite signal in parentheses.
A partir del hecho que el lugar y la condición de las praderas (i.e., sanas o infectadas) tuvieron un efecto importante en la variabilidad de los perfiles de metabolitos detectados por GC-MS, el análisis detallado permitió determinar que en hojas de plantas sanas de las praderas del parque Tayrona en las bahías de Neguanje y Chengue se comparte la acumulación de la mayoría de metabolitos, ejemplo, xilosilglucosa, ácido 3-oxobutanóico y sucrosa, y hay mayor abundancia de estos en Neguanje que en Chengue. Por su parte, el ácido 3-deshidroshiquímico fue acumulado mayoritariamente tanto en hojas de la bahía de Chengue como de Providencia. Por otra parte, en los rizomas de plantas sanas se observó que en las tres praderas se acumuló mayoritariamente la Talosa y el glicerol, siendo muy abundante en Providencia, seguido por Chengue y luego Neguanje. En esta última pradera se observó además una amplia variedad de metabolitos en alta abundancia respecto de las otras áreas, como fueron algunos azúcares y alcoholes en rizomas sanos. En praderas de Providencia, se detectaron altos niveles de metabolitos únicos para el área como la ribono-1,4-lactona y el ácido cafeico en hojas y el ácido 3-oxobutanoico en rizomas de plantas sanas (Tabla 4).
Por otro lado, en las praderas infectadas los metabolitos mayoritariamente acumulados en hojas y rizomas fueron diferentes a los encontrados en praderas sanas. En hojas infectadas de los tres sitios, se encontraron compuestos comunes como la 3-hidroxi-2-isopentanona y el sitosterol, y en los rizomas infectados la glucosa y la isopent-3-en-2-ona, mostrando mayor abundancia en Chengue seguido por Providencia y por Neguanje. Los datos indicaron que las plantas infectadas inducen el incremento de compuestos propios en cada área como glucosa y estigmasterol en hojas y ácido isopentanóico y acetato de octadecilo en rizomas de la bahía de Chengue; el 4-acetil-1-metilciclohexeno en rizomas de Providencia y el ácido octadecatrienoico en rizomas de Neguanje.
Discusión
Dado que a nivel mundial en regiones tropicales y templadas se ha presentado una disminución en la extensión de los pastos marinos por diferentes factores antropogénicos y naturales, incluidas las enfermedades ocasionadas por diferentes patógenos (Bergmann et al., 2010; Bull et al., 2012; Papenbrock, 2012), a partir del 2014 se estableció un protocolo para determinar las condiciones en las que se encuentran las praderas de pastos marinos en el Caribe Colombiano, dentro de las que se incluye la estimación del porcentaje de afectación de las praderas de T. testudinum por Labyrinthula spp. (Galeano et al., 2016; Gómez-López et al., 2014). En este contexto, se ha observado variación espacio-temporal en la afectación de dichas praderas por esta enfermedad en varias áreas del Caribe (Galeano et al., 2016; Gómez-López et al., 2018), sin embargo, este es el primer estudio que simultáneamente analiza datos epidemiológicos y ambientales y compara el perfil metabólico de plantas sanas e infectadas, como un primer paso en el estudio de la respuesta de la planta ante la presencia del patógeno.
Los resultados indican que en Providencia las lluvias detectadas en la zona durante el muestreo conllevaron a un leve incremento de nutrientes en el agua y disminución de la salinidad (35.1 psu) lo que, aunado a una mayor densidad de vástagos, pudo favorecer una mayor infección de las praderas de Thalassia testudinum en esta área, en comparación con las praderas de las bahías de Chengue y Neguanje en el PNNT, corroborando estudios previos de Jakobsson-Thor et al. (2018), Groner et al. (2014) y Groner et al. (2016) y quienes observaron una mayor diseminación de la enfermedad en praderas someras con alta densidad de vástagos. En Providencia, aunque los valores de nitrato y fósforo alcanzaron los 30 y 9.2 µg/l, respectivamente, fueron menores que los reportados en el mes de junio (época seca) en el mismo sector de McBean Lagoon, donde llegaron hasta 55 y 82 µg/l, respectivamente. Lo anterior denota el ingreso de nutrientes por actividad agrícola y el aporte de aguas residuales en el área, reportado previamente por INVEMAR (2020), que conllevan a la disminución de oxígeno (< 1.85 mg/l) y al incremento de coliformes termo tolerantes en aguas superficiales. Estos datos corroboran estudios previos en los que se ha reportado que incrementos de nitrato, de 7 µM hasta 68 µM, aumentan la susceptibilidad a la infección en praderas de Z. marina (Hughes et al., 2018).
Por otra parte, en Chengue, se detectó una baja incidencia de la enfermedad en praderas con menor nivel de nutrientes y menor densidad de vástagos y, aunque los valores de nitrato y fósforo reportados en este estudio fueron mayores que los reportados previamente en época seca (junio 2019) en dicha bahía (INVEMAR, 2020), se encuentran dentro del rango establecido en aguas naturales para la preservación de fauna y flora, de acuerdo con la Norma colombiana (Ministerio de Ambiente y Desarrollo Sostenible, 2015) y están en correspondencia con los cuantificados en esa área desde el 2008 (INVEMAR, 2008).
Aunque varios estudios indican que la descarga de nutrientes desde las áreas costeras ha llevado a una disminución de las praderas marinas (Orth et al., 2006), afectando su biomasa (Kaldy et al., 2017), su integridad estructural (Burkholder et al., 1992) y facilitando la penetración de Labyrinthula spp. (Vergeer et al., 1995), los resultados en este caso no mostraron diferencias significativas entre los niveles de nutrientes presentes entre las praderas de los tres sectores analizados, que permita establecer una relación directa con la incidencia de la enfermedad. Por lo cual, es necesario complementar los estudios en el Caribe Colombiano a nivel espacio-temporal, incluyendo factores como turbidez, oxígeno disuelto, presencia de contaminantes orgánicos, de metales pesados, de nutrientes y de sulfuros en sedimentos, que se sabe pueden en conjunto, contribuir a aumentar la susceptibilidad a la infección; y en el caso de Providencia incluso analizar la influencia de corrientes marinas dado que en monitoreos de años anteriores se ha observado una mayor incidencia de la enfermedad en esta isla, a diferencia de lo observado en el continente, específicamente en el PNNT.
Por otra parte, estudios en praderas en Cuba (Rodeiro-Guerra, 2019) reportan niveles similares de materia orgánica y carbono orgánico en sedimentos a los cuantificados en este estudio. Sin embargo, estos últimos son valores bajos para el desarrollo de los pastos de acuerdo a Koch (2001), quien establece que un 4 % de carbono orgánico es el óptimo para el crecimiento de las praderas, lo cual podría incidir sobre el bajo número de vástagos encontrados en las praderas del PNNT. Con respecto al efecto de la salinidad y la temperatura sobre la incidencia de la enfermedad en T. testudinum, se reporta solo el estudio de Bishop (2013), quien en microcosmos determinó que Labyrinthula spp. es muy sensible a la variación en salinidad (< 15 ppt y > 50 ppt) y que a salinidades de 30 psu y 30 °C, tiene una buena capacidad infectiva. Sin embargo, las praderas en el Caribe Colombiano se encuentran dentro de un rango de temperatura (28-33 °C) y salinidad (24-35 psu) óptimo para su desarrollo (IFAS, 2007), lo cual explicaría que la afectación de la enfermedad sea baja y no ocasione mortalidades de las praderas, inclusive cuando su incidencia ha sido mayor, como se observó en Providencia en junio del 2014, en donde más del 60 % de la pradera presentó síntomas de la enfermedad, pero ya en octubre del mismo año la incidencia había disminuido casi en totalidad (Galeano et al., 2016).
Los datos indican que las praderas de T. testudinum en las tres áreas muestreadas se encuentran en una buena condición, a pesar de presentar síntomas de la enfermedad del desgaste. Esto concuerda con la información recopilada por el INVEMAR en los últimos 6 años (Galeano et al., 2016; Gómez-López et al., 2018; Gómez-López et al., 2020), en la que se ha observado que, a pesar de ser afectados relativamente con frecuencia por este hongo, el sistema de defensa de las plantas le ha permitido mantenerse sin pérdidas evidentes en el tiempo.
Esta respuesta de T. testudinum frente Labyrinthula spp. logró ser explorada mediante perfilado metabólico como abordaje holístico. Esta exploración se constituye en el primer estudio que se desarrolla en Colombia para este patosistema, representando una importante contribución a la caracterización química de T. testudinum por GC-MS y LC-MS. De esta manera, se describe la presencia y acumulación mayoritaria, por efecto del lugar de muestreo, parte de la planta y condición sanitaria, de algunos metabolitos que no habían sido reportados previamente, que fueron detectados e identificados por GC-MS, y que fueron categorizados por análisis univariado, como son el ácido octadecatrienoico, 2,6-dimetilbenzenetiol, 2-feniletanetiol, 3-hidroxi-2-isopentanona, isopent-3-en-2-ona, xilosilglucosa, ácido 3-oxobutanóico y el ácido 3-deshidroshiquimico. Para el caso de los compuestos de naturaleza fenólica detectados por LC-MS, 15 compuestos fueron resaltados por análisis multivariado como responsables de la discriminación estadística de las muestras, siendo los flavonoides conjugados 3’,4’-O-dimetil luteolin 7-glucosilsulfato, acacetina 7-glucósido, diosmetina 7-glucósido, luteolina 7-sulfato, diosmetina 7-sulfato, 3’,4’-O-dimetilluteolin 7-sulfato, y los flavonoides libres luteolina, eriodictiol, apigenin, naringenina, y diosmetina, metabolitos muy comunes en pastos marinos pero sin reportes previos en T. testudinum (Jeyapragash et al., 2018). También se observó que los metabolitos encontrados en plantas sanas difieren de los encontrados en plantas enfermas al igual que los detectados entre hojas y rizomas, incluso dependiente del lugar, lo cual fue evidente en la cuantificación de los contenidos totales de fenoles y flavonoides, cuyos niveles se encontraron en un rango entre 84.4 y 11.7 mg EAG/g MS para CTFe y entre 55.5 y 2.85 mg EQ/g MS para CTFl, los cuales estuvieron de acuerdo a lo reportado previamente por otros autores para muestras de T. testudinum recolectadas en la playa Rincón de Guanabo y la bahía Little Lameshur de las islas vírgenes de USA (Arnold et al., 2008; González et al., 2016; Regalado et al., 2012).
Los compuestos encontrados en los extractos etanólicos de las muestras, analizados tanto por LC-MS como por GC-MS, incluyeron azúcares, ácidos grasos, esteres, cetonas, terpenos, fenoles, flavonoides libres, flavonoides glicosilados y flavonoides sulfatados. Varios estudios han reportado que los fenoles, como el ácido cafeico, pueden asociarse a la resistencia a Labyrinthula spp. en Z. marina y T. testudinum, incluso inhibiendo su crecimiento in vitro (Buchsbaum et al., 1990; Groner et al., 2016; Trevathan-Tackett et al., 2015; Vergeer et al., 1995) como una respuesta de defensa constitutiva. No obstante, los niveles de ácido cafeico se mostraron aumentados por efecto de la presencia del hongo, como se observa en la Fig. 4B, donde la abundancia relativa de este compuesto fue significativamente contrastante entre hojas sanas e infectadas, relacionándose su acumulación a la presencia de Labyrinthula spp. al hacer la comparación de los perfiles detectados por LC-MS. Contrariamente, los niveles de ácido cafeico detectado por GC-MS no mostraron esta tendencia, dado que las hojas aparentemente sanas de praderas de Providencia mostraron abundancia mayores, lo cual podría estar relacionado con una respuesta constitutiva o dependiente de una fase inicial de defensa ante la presencia de epífitas, la cual fue muy abundante en estas praderas, en concordancia con lo reportado por Subhashini et al. (2013). De igual manera, estos niveles particulares podrían indicar una respuesta ante la presencia del endófito en plantas asintomáticas, lo cual ha sido reportado como muy común en praderas a través de pruebas de PCR (Bockelmann et al., 2013), o simplemente, otros metabolitos acumulados fueron detectados mayoritariamente por GC-MS en comparación a los fenólicos en respuesta a la presencia del hongo, principalmente precursores con unidades C5, particularmente la 3-hidroxi-2-isopentanona, isopent-3-en-2-ona, y el ácido isopentanóico. Estas observaciones se suman al hecho que varios reportes también indican que la presencia de ácidos fenólicos en las plantas pueden incrementar hasta en 4 veces en condiciones de poco nitrógeno (Buchsbaum et al., 1990) y que factores ambientales como turbidez, acidificación, baja salinidad (Sneed, 2005) y contaminación con metales pesados (Ferrat et al., 2012) determinan cambios en su concentración, lo cual explica la variación entre lugares (más evidentes en los perfiles por GC-MS), por lo cual es importante realizar estudios complementarios en el área para examinar dichos aspectos.
Los datos muestran que hay metabolitos secundarios que sólo aparecen en hojas o en rizomas de plantas infectadas indicando diferencias en los procesos metabólicos que tienen lugar en cada órgano como ha sido reportado previamente (Migliore et al., 2007). Entre ellos se encontró, por análisis con GC-MS, la 3-hidroxi-2-isopentanona en solo las hojas infectadas de las 3 áreas de estudio y ácido isopentanóico (ácido isovalérico) y ácido octadecatrienoico, solo en rizomas infectados. El ácido isovalérico ha sido detectado en Halodule pinifolia (Jeyapragash et al., 2018) y el octadecatrienoico en Syringodium isoetifolium, este último es una oxilipina del sistema inmune de la planta, reportada con capacidad antiincrustante, antibacteriana y antifúngica (Palanisamy et al., 2014). También se detectaron compuestos como el 2,6-dimetilbenzenetiol, 2 fenil etanotiol, isopent-3-en-2-ona y azúcares reductores como la glucosa, principalmente en rizomas infectados de las tres áreas de estudio. La presencia de glucosa concuerda con resultados previos de Yero-Espinosa et al. (2017) quienes detectaron azúcares reductores en extractos acuosos y etanólicos de plantas completas de T. testudinum, así como De la Torre et al. (2012) y García-Granados et al. (2019), quienes sugieren que los azúcares son usados como reserva energética por la planta y específicamente los que están contenidos en los rizomas (órganos de almacenamiento de energía) pueden ser determinantes en la tasa de recuperación de la biomasa foliar (Dawes & Lawrence, 1979), en este caso dada por la muerte de hojas infectadas. También se reporta que estos carbohidratos pueden acumularse sobre los sitios de infección para ser usados en la síntesis de compuestos fenólicos que causan la necrosis celular como primera etapa de la defensa constitutiva de la planta (Steele et al., 2005). Lo anterior se sustenta en el hecho que, luego del análisis multivariado contrastante entre plantas sanas y enfermas, se observó que el número de azúcares fue menor en plantas infectadas, favoreciendo la acumulación particular de glucosa. En cuanto a las pentanonas, éstas no han sido reportadas para T. testudinum, pero si se ha reportado su presencia en plantas (Cheng et al., 2020; Vivaldo et al., 2017) y macroalgas como oxilipinas volátiles de cadena corta, como las pent-3-en-2-ona y las hidroxi-pentanonas, cuya función es alertar a través del medio acuático de la presencia de patógenos (Chen et al., 2019), lo que apoyaría la alta abundancia relativa detectada de la hidroxi-2-isopentanona en hojas de praderas infectadas en las tres áreas.
También se detectó por GC-MS la presencia de esteroles como el sitosterol y estigmasterol, que son muy comunes en plantas, y tienen un efecto protector contra rayos UV y ayudan en la estructura de las células y las membranas. Por lo tanto, su presencia solo en hojas infectadas sugiere su síntesis para reconstrucción de los tejidos dañados por efecto del protista. Varios autores han reportado altos niveles de esteroles tipo sitosterol y estigmasterol en Thalassia testudinum en India, el Caribe y Australia (Gillan et al., 1984; Govidan et al., 1993; Riera-Romo et al., 2018) al igual que en Posidonia oceanica y Halodule uninervis (revisado en Zidorn (2016)), con propiedades citotóxicas y farmacológicas. La sobrerregulación de azúcares reductores y esteroles podría originarse como una respuesta inmune ya que, como ha sido reportado previamente, en plantas en condiciones de estrés se presentan rearreglos en aminoácidos, ácidos orgánicos, azúcares (i.e., sacarosa, fructosa, ribulosa y trehalosa), polioles y alcoholes derivados de azúcares (i.e., manitol, mio-inositol, y ribitol), que tienen propiedades protectoras con efectos antioxidantes y osmorreguladores (Kumar, 2016). Por otro lado, en plantas sanas se encontró la acumulación mayoritaria de metabolitos diferentes a los encontrados en plantas infectadas, entre ellos se encontraron para las hojas la xilosilglucosa, ácido-3-oxobutanoico (ácido acetoacético), sucrosa, y ácido-3-deshidroshiquimico, este último involucrado en la biosíntesis de aminoácidos aromáticos por la ruta del ácido shikímico. Para el caso de los rizomas se encontró la talosa, glicerol, y otros azúcares y alcoholes sintetizados como fuente de reserva energética. Entre ellos no se han reportado previamente para T. testudinum xilosilglucosa, ácido-3-oxobutanoico, ni ácido-3-deshidroshiquimico.
En relación a los flavonoides detectados por LC-MS, se encontró un menor número de metabolitos asociados a este grupo que influenciaron la discriminación estadística bifactorial, supervisando simultáneamente por lugar y por condición sano o enfermo. De esta manera, cuatro flavonoides (de los doce categorizados) fueron determinantes en la discriminación bifactorial de las plantas infectadas, dado que se relacionaron de una manera estadísticamente significativa con las plantas infectadas. Estos metabolitos, que hacen parte del subgrupo de las flavonas, particularmente del tipo luteolina y diosmetina, los cuales están estructuralmente diferenciados únicamente por una metilación en el oxígeno del carbono 3’, se acumularon de forma libre (como la luteolina), sulfatados (como la diosmetina 7-sulfato y la luteolina 7-sulfato), o glucosilsulfatados (como la dioesmetina 7-O-glucosilsulfato, también llamada thalassiolina B). Este último metabolito está de acuerdo a lo reportado por Trevathan-Tackett et al. (2015), quienes describieron el efecto directo de la thalassiolina B, aislada de un ejemplar de T. testudinum recolectado en praderas de Long Key Florida, USA, sobre el crecimiento de Labyrinthula spp. en medio suplementado. De esta manera, encontraron que esta flavona glucosilsulfatada tenía un efecto antifúngico entre 20 a 100 veces mayor que otros ácidos fenólicos evaluados, con un IC50 de 30.6 µM. Este hecho está en concordancia con lo indicado por Jensen et al. (1998), quienes también encontraron evidencia que la thalassiolina A (i.e., luteolina 7-O-glucosilsulfato), aislada de un ejemplar de T. testudinum recolectado en la isla Little San Salvador de las Bahamas, se comporta como un metabolito de defensa contra el hongo zoospórico Schizochytrium aggregatum, el cual fue considerado en su momento como un antibiótico tipo flavona glucosilsulfatada con efecto antiincrustante ecológicamente relevante (Jensen et al., 1998). La ocurrencia de este tipo de flavonoides glucosilsulfatados (aunque también los flavonoides sulfatados) se ha visto más favorecida en halófitas, constituyéndose en una adaptación fisiológica al medio marino (Teles et al., 2018). No obstante, aunque se han evidenciado algunas funciones ecológicas para los flavonoides de origen marino, se ha precisado también que varios de los flavonoides sulfatados tienen roles claros en la defensa química antimicrobiana de pastos marinos, como T. testudinum. Todo lo anterior racionaliza el hecho de encontrar mayoritariamente acumulados estos cuatro flavonoides sulfatados de tipo luteolina y diosmetina, con niveles significativamente contrastantes y consistente en los tres lugares de muestreo, relacionados a las plantas infectadas de T. testudinum con Labyrinthula spp., lo cual es un indicio de su participación en la defensa química del pasto contra este protista.
Nuestros resultados complementan la información previa en la que se menciona que T. testudinum es fuente de ácidos fenólicos, cumarinas, flavonas, taninos, lignanos, fitoesteroles, esteroides, diterpenos, triterpenos y saponinas, los cuales han sido detectados por diferentes metodologías, y cuya biosíntesis es el reflejo de interacciones bióticas y abióticas (García-Granados et al., 2019; De la torre et al., 2012; Regalado et al., 2012). En un estudio reciente de Papazian et al. (2019) detectaron, además de flavonoides sulfatados (ácido rosmarinico, diosmetina, apigenina y luteolina), otros metabolitos como ácidos carboxílicos alifáticos (ácido azelaico), ácidos grasos (involucrados en la protección estructural y respuesta inmune) y trehalosa. Todos estos metabolitos generados por el pasto marino como mecanismo antiincrustante. Por otro lado, en este estudio también se detectaron metabolitos conocidos con variadas aplicaciones, como lo son la isopent-3-en-2-ona, el dimetilbenzenetiol, usados como aditivos de alimentos (Subhashini et al., 2013), el ácido cafeico y glicerol usados en el desarrollo de compuestos farmacológicos (Riera-Romo et al., 2018), los flavonoides libres y conjugados, derivados de la naringenina y la apigenina, que son importantes antioxidantes (Brunetti et al., 2013), y el ácido octadecatrienoico usado en el control de patógenos y formación de biopelículas (Kumar, 2016), lo cual abre nuevas perspectivas de investigación en el país.
Finalmente, el presente estudio es un primer esfuerzo enfocado hacia la caracterización metabólica de pastos marinos recolectados en lugares con características biológicas y fisicoquímicas distintas pero ubicados en las inmediaciones del Caribe Colombiano, el cual resultó en la identificación y reconocimiento de varios metabolitos de diferente naturaleza, y que serían ecológicamente relevantes dado que son el indicio de una respuesta del pasto marino al ambiente y a la presencia del protista. No obstante, aunque el análisis metabolómico, bajo un enfoque basado en perfilado metabólico, permite una visión general de la respuesta de la planta ante la presencia del endófito, hay aspectos en la eco fisiología de la planta que pueden limitar la fidelidad de los resultados y que, por consiguiente, es altamente positivo que sean abordados en estudios posteriores, incluso en condiciones controladas. Entre ellos están los efectos del ambiente sobre la relación hospedero-patógeno que se desconoce en este caso. También la amplia diversidad genética intra poblacional de Labyrinthula (más de 46 especies), que incluso hace que en la misma área se encuentren praderas muy afectadas, mientras otras parecen sanas o asintomáticas lo cual, aunque ha sido reportado en áreas templadas (Bockelmann et al., 2012), no se conoce para el Caribe. De igual manera, la variación que puede darse por edad de las plantas y por el tipo de muestras, y no menos importante, el procedimiento de extracción y la técnica usada para el análisis que, como reporta Subhashini et al. (2013) y se vio en el presente estudio, determina el enfoque a estudiar basado en la información aportada por los perfiles metabólicos obtenidos.
Declaración de ética: los autores declaran que todos están de acuerdo con esta publicación y que han hecho aportes que justifican su autoría; que no hay conflicto de interés de ningún tipo; y que han cumplido con todos los requisitos y procedimientos éticos y legales pertinentes. Todas las fuentes de financiamiento se detallan plena y claramente en la sección de agradecimientos. El respectivo documento legal firmado se encuentra en los archivos de la revista.












 uBio
uBio 


