Introducción
México es un país con alrededor del 11 % de las especies de aves del mundo, de las cuales 20 % restringen su distribución al territorio nacional y de ellas 26-33 % se encuentran en alguna categoría de amenaza, de acuerdo con clasificaciones nacionales e internacionales (Navarro-Sigüenza et al., 2014). Es notable una concentración del endemismo en el occidente de México (sensu Peterson & Navarro-Sigüenza, 2000), región para la que se registra entre el 40-47 % de las especies endémicas del país (García-Trejo & Navarro-Sigüenza, 2004; Peterson & Navarro-Sigüenza, 2000), por lo que esta zona es de relevancia para el estudio y la conservación de la avifauna.
El análisis de gradientes se ha utilizado para tratar de explicar la distribución y abundancia de los organismos (Ter Braak & Prentice, 2004; Whittaker, 1967), siendo la elevación uno de los factores más socorridos por su fácil medición, a pesar de tratarse de un gradiente complejo, ya que con él covarían otros factores ambientales (Lookingbill & Urban, 2005). El uso de este gradiente ambiental para el estudio de la avifauna está ampliamente documentado (Almazán-Núñez et al., 2020; Jaime-Escalante et al., 2016; Martínez & Rechberger, 2007; Medina-Macías et al., 2010; Navarro-Sigüenza, 1992; Santana et al., 2017; Terborgh, 1977). Se ha registrado una disminución monotónica de la riqueza de las especies de aves con el incremento de la elevación (Kattan & Franco, 2004; Martínez & Rechberger, 2007; Medina-Macías et al., 2010; Navarro-Sigüenza, 1992; Santana et al., 2017; Terborgh, 1977), pero también una distribución de la riqueza en forma unimodal (Almazán-Núñez et al., 2009; Herzog et al., 2005; Jaime-Escalante et al., 2016), patrón que se acentúa más cuando se estandariza la riqueza de especies en función del área (Kattan & Franco, 2004; Rahbek, 1995).
Se ha documentado que la riqueza de especies residentes declina con la elevación, con una mayor concentración en elevaciones menores a 1 500 m (Navarro-Sigüenza, 1992; Santana et al., 2017), mientras que el endemismo se incrementa a elevaciones por arriba de los 1 800 m (González-García & Gómez de Silva, 2002; Martínez & Rechberger, 2007).
Si bien, se han encontrado especies que se distribuyen a través de gradientes ambientales amplios, la mayoría de ellas se restringen a una parte de ellos, por lo que se han utilizado como indicadoras de ecosistemas (Almazán-Núñez et al., 2009; Jaime-Escalante et al., 2016; Ornelas & Lara, 2002; Vega-Rivera et al., 2010). Se considera que los cambios en la composición de especies a través del gradiente elevacional, refleja cambios ambientales y que por consiguiente la distribución de las especies permitiría formular hipótesis de los factores que podrían ser causantes de los cambios (Navarro-Sigüenza, 1992). Dado que hay especies que comparten preferencias ambientales, entonces se esperaría poder determinar especies indicadoras a través del gradiente, sobre todo donde pudieran presentarse discontinuidades ambientales, que se expresen a través de comunidades vegetales, lo cual se ha documentado que está fuertemente relacionado con los cambios en la riqueza de especies de aves (Jaime-Escalante et al., 2016; Terborgh, 1977).
Con este estudio se pretende: (1) caracterizar la composición y la diversidad avifaunística a través de un gradiente elevacional y; (2) analizar si hay especies de aves indicadoras que permitan el reconocimiento de grupos a través del gradiente. Partimos de la hipótesis de que existe un cambio en la composición de especies de aves y una disminución de la riqueza con la elevacional, por lo que habrá especies que coincidan en su distribución elevacional, formando grupos diferenciables a través del gradiente.
Materiales y métodos
Área de estudio: La investigación se realizó en el occidente de México, al noroeste de la Reserva de la Biosfera Sierra de Manantlán (RBSM), en el municipio de Autlán de Navarro, en el estado de Jalisco, dentro del ejido de Ahuacapán, por el camino del poblado de Ahuacapán a Corralitos, por la brecha a la estación Científica Las Joyas, iniciando en las coordenadas (19°39’48” N & 104°19’15” W) y terminando en (19°37’32” N & 104°18’39” W). El clima es subtropical subhúmedo estacional, con una marcada temporada de lluvias de mayo a septiembre y un periodo de sequía de finales de septiembre a principios de mayo, con lluvias ocasionales durante el otoño e invierno; la precipitación y temperatura media anual es de 1 000 a 1 200 mm y 18 a 20 °C, respectivamente (Instituto Nacional de Ecología, 2000). La vegetación corresponde a bosque tropical caducifolio (BTC), bosque de encino (BQ), bosque de pino-encino (BPQ) y bosque de pino (BP).
El BTC se encontró entre los 1 000-1 300 m.s.n.m. de elevación, teniendo entre las especies más importantes a Bursera bipinnata, B. grandifolia, B. kerberi, B. penicillata, Ceiba aesculifolia, Ipomoea arborescens, I. bracteata, Pachycereus pecten-aboriginum, Pseudobombax ellipticum, Salvia iodantha y Stenocereus queretaroensis. Entre los 1 300-1 400 m.s.n.m., se reconoció una zona de transición entre BTC y BQ. Por arriba de esta condición y hasta los 1 550 m.s.n.m. se encontró BQ con Quercus castanea, Q. magnoliifolia y Q. resinosa, entre otras. El BPQ se registró entre los 1 600-1 900 m.s.n.m., con Pinus douglasiana, P. maximinoi, P. oocarpa, Q. castanea, Q. magnoliifolia y Q. resinosa. Por arriba de los 1 900 m.s.n.m. de elevación, se localizó BP con P. douglasiana, P. herrerae y P. oocarpa, en el estrato arbóreo y con Calliandra longipedicellata, Fuchsia encliandra, Phytolacca icosandra, Rubus adenotrichos, S. iodantha, S. mexicana, Solanum nigricans y Vaccinium stenophyllum en el estrato arbustivo (Vázquez & Cuevas, 1995).
Muestreo de aves: Se establecieron 28 puntos de conteo fijos (PCF) a lo largo de un transecto de 7 km de longitud, cubriendo un gradiente elevacional de 1 000 m (de los 1 000 a 2 000 m.s.n.m.). Cada PCF estuvo separado entre si 250 m y en cada uno de ellos, se realizaron conteos la primera y tercera semana de cada mes, para un total de 24 muestreos por PCF. Los individuos de cada especie fueron considerados sólo una vez en cada punto conteo y se partió de la consideración de que 250 m de separación entre cada PCF era suficiente para considerar los individuos de las especies como diferentes (González-García, 2011), por lo que cada frecuencia de observación se consideró como un individuo. Los muestreos se realizaron de julio 2016 a junio 2017, aplicando el método de punto conteo de radio ilimitado (Ralph et al., 1996), el cual consistió en registrar todas las especies y el número de individuos de aves observadas y escuchadas en un lapso de 8 min, desde el amanecer y hasta las 11 de la mañana. Este período de tiempo (8 min) se ha registrado como suficiente para captar al menos el 80 % de las especies (González-García, 2011; Vogeler et al., 2014). Por lo tanto, el esfuerzo de muestreo empleado en cada ocasión en cada PCF fue de 1 hombre/8 min. La observación de las aves se realizó con binoculares Bushnell 10 × 32 y en todas las ocasiones fue realizado por el mismo observador. La identificación se hizo con guías de campo especializadas como Howell y Web (1995) y National Geographic (2002). Para la identificación de las especies por sus cantos y llamados se tuvo un entrenamiento previo de varios años, aquellos no identificados fueron registrados y consultados con expertos y se corroboraron en la base de datos de Xeno-canto (2016).
Análisis de los datos: Para los nombres científicos de las especies se siguió la nomenclatura de la American Ornithological Society (2019) y para la clasificación de su estacionalidad la propuesta de Howell y Webb (1995). Para los niveles de endemismos se utilizaron las categorías de endémica de las montañas de México y endémica al oeste de México (Contreras-Martínez et al., 2017; Navarro-Sigüenza et al., 2014). Los estados de conservación de las especies fueron establecidos de acuerdo con las categorías de amenaza propuestas a nivel internacional (Partners in Flight, 2019) y nacional a través de la NOM-059-SEMARNAT (Diario Oficial de la Federación, 2010).
Para la comparación de la composición y diversidad de especies, así como la distribución de las especies endémicas y en alguna categoría de riesgo a través del gradiente elevacional, se establecieron cinco franjas elevacionales (FE) de 200 m cada una. Estudios previos han considerado esta amplitud elevacional como suficiente para captar los cambios en la composición y diversidad de las especies (Contreras-Martínez et al., 2017; Terborgh & Weske, 1975).
La F1 fue de los 1 000-1 200 m, la F2 de 1 200-1 400 m, la F3 de 1 400-1 600 m, la F4 de1 600-1 800 m y la F5 de 1 800-2 000 m. Los PCF se agruparon en función de la elevación: F1 (PCF 1-6), F2 (7-11), F3 (12-15), F4 (16-20) y F5 (21-28). Utilizando los 24 muestreos del ciclo anual en cada PCF y los últimos agrupados por franja elevacional, se realizaron curvas de interpolación y extrapolación para datos de abundancia con la finalidad de comparar la riqueza de especies entre franjas a un mismo tamaño de la muestra y determinar la completitud del muestreo (Colwell et al., 2012). El análisis se realizó con el software iNEXT con las opciones, método de remuestreo bootstrap con 50 interacciones con un intervalo de confianza del 95 % y con 391 individuos como muestra de estandarización, que fue el número menor de individuos registrados en la F3 (Chao et al., 2016). También se estimó la diversidad verdadera por franja elevacional a través de los números de Hill de orden 0, 1 y 2 (Jost, 2007; Jost & González-Oreja, 2012). Estas medidas tienen la ventaja de que sus unidades resultantes son número efectivo de especies en la comunidad, satisfacen algunos principios matemáticos como el de duplicación y permiten comparaciones estadísticas más realistas que los índices de entropía. Estas medidas se estiman a través de órdenes de diversidad, el orden indica la sensibilidad a la presencia de las especies comunes y raras, siendo el orden cero equivalente a la riqueza de especies (insensible a la abundancia de las especies), el orden 1 pondera dando igual peso a las especies raras y comunes y el orden 2 da mayor peso a las especies dominantes (Jost, 2007). Para la estimación de los números de Hill se utilizó el software Primer V.7 (Clarke et al., 2014). Se aplicó un análisis de varianza no paramétrico con la prueba de Kruskall-Wallis, para ver si había diferencias significativas para la diversidad de especies entre FE, utilizando el software InfoStat (Di Rienzo et al., 2016).
Se realizó el Procedimiento No Paramétrico de Permutación Multirespuesta (MRPP), en busca de diferencias en la composición y abundancia de las especies entre las FE, bajo la H0 de la no existencia de diferencias estadísticas entre dos o más grupos de entidades definidas a priori, generando primero una matriz de distancia entre los PCF, utilizando para nuestro análisis la distancia Sorensen (Bray-Curtis), luego se calculó la distancia promedio entre los PCF de cada FE, determinando en seguida la distancia ponderada por franja (delta = δobs), seguido de procesos de permutación para determinar las δ esperadas (δesp) y con ello se generó un estadístico de prueba (T), que es igual a la diferencia entre las δobs y δesp divididos por la desviación estándar de las δesp, esta prueba describe la separación entre las franjas, a valores más negativos más fuerte las diferencias entre las franjas. También se determinó el estadístico A para evaluar el tamaño del efecto de la independencia del tamaño de la muestra, lo que se conoce como acuerdo intra-grupo corregido por azar, necesario para determinar el valor de p. Para información más detallada sobre el procedimiento ver McCune y Mefford (2011). Para realizar el MRPP, se integró una matriz de abundancia, considerando como abundancia el número de individuos de cada especie registrados por PCF durante los 12 meses de muestreo. Cada PCF fue asignado a la franja elevacional correspondiente en función de su elevación. La matriz de abundancia fue estandarizada, dividiendo el valor de abundancia de una especie en cada PCF, entre la suma de abundancias en los puntos de conteo en que se registró la especie, multiplicando el resultado por 100. El procedimiento MRPP se realizó con el software PC-ORD V.6 (McCune & Mefford, 2011).
Se realizó un Análisis de Especies Indicadoras (AEI) con el procedimiento de Dufrene y Legendre, como se consigna en PC-ORD V.6 (McCune & Mefford, 2011). El método combina información sobre la concentración de la abundancia de especies en un grupo particular y la fidelidad de la ocurrencia de una especie en ese grupo, produce valores indicadores para cada especie en cada grupo, los cuales se someten a una prueba de significancia estadística (McCune & Mefford, 2011). Para el AEI se utilizó la matriz de abundancia por PCF, incluyendo las 129 especies de aves registradas en el muestreo.
La relación entre el cambio en la riqueza y abundancia de especies en el gradiente elevacional se evaluó empleando dos enfoques metodológicos: (a) una prueba de correlación de Pearson (Di Rienzo et al., 2016) y, (b) un Análisis de Escalamiento Multidimensional No Métrico (NMS), utilizando la matriz de abundancia de las especies que se presentaron en 3 o más PCF durante todo el muestreo, transformada con doble raíz cuadrada (Clarke et al., 2014), con el procedimiento de modo automático con distancia Sorensen, 500 iteraciones como máximo, con el tiempo como número aleatorio de semilla, 250 iteraciones con los datos reales y 250 con los datos aleatorizados, utilizando el software PC-ORD V.6 (McCune & Mefford, 2011).
Resultados
Composición y diversidad avifaunística a través del gradiente elevacional: Las curvas de muestreo de interpolación y extrapolación indican que la completitud del muestreo para todas las franjas elevacionales fue superior al 96 % (F1 = 99 %, F2 = 98 %, F3 = 96 %, F4 = 97 % y F5 = 99 %). Se registraron 4 588 individuos de 32 familias, 90 géneros y 129 especies de aves, a través del gradiente elevacional. Las familias con más especies fueron Parulidae con 20, Trochilidae, Tyrannidae con 12 y Cardinalidae con 11, mientras que Trogonidae, Psittacidae y Momotidae fueron las que tuvieron menos (Tabla 1). Los géneros con mayor riqueza de especies fueron Setophaga con seis e Icterus, Passerina y Piranga con cinco cada uno (Tabla 1). De acuerdo con las curvas de interpolación y extrapolación la mayor riqueza de especies fue para las F1 y F2 y la menor para la F3 (Fig. 1).
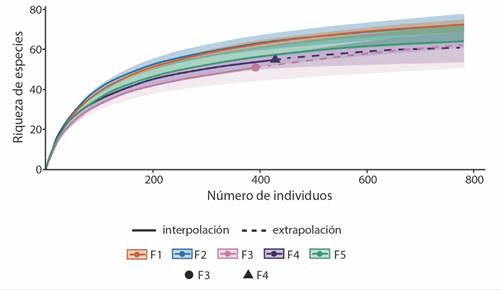
Fig. 1 Curvas de interpolación y extrapolación para ver completitud de muestreo y comparar riqueza de especies entre franjas elevacionales. F1 = 1 000-1 200 m de elevación, F2 = 1 200-1 400 m, F3 = 1 400-1 600 m, F4 = 1 600-1 800 m, F5 = 1 800-2 000 m. / Fig. 1. Interpolation and extrapolation curves to see sampling completeness and compare species richness between elevation belts. F1 = 1 000-1 200 m de elevación, F2 = 1 200-1 400 m, F3 = 1 400-1 600 m, F4 = 1 600-1 800 m, F5 = 1 800-2 000 m.
La prueba no paramétrica de Kruskall-Wallis mostró diferencias significativas para la riqueza de especies (g.l. = 4, H = 13.97, P ≤ 0.008), siendo F1 estadísticamente diferente de la F3 y F4 y la F2 de la F3 (Fig. 2). La misma prueba, pero para la abundancia de individuos mostró diferencias significativas (g.l. = 4, H = 15.5, P = 0.004) entre la F1 con la F3, F4 y F5, pero no con la F2 (Fig. 3). La mayor riqueza de especies y abundancia de individuos se registró en la F1 y F2 y las menores en la F3, con un ligero incremento en las F4 y F5 (Fig. 2, Fig. 3). La diversidad de orden 2 de Hill, presentó un patrón similar a la riqueza de especies, registrándose el mayor número efectivo de especies entre los 1 000-1 400 m. Se observó un patrón inversamente correlacionado entre la riqueza y abundancia de las especies con la elevación de los PCFs (R = - 0.508, g.l. = 27 P < 0.01; R = -0 .590, g.l. = 27, P < 0.001).
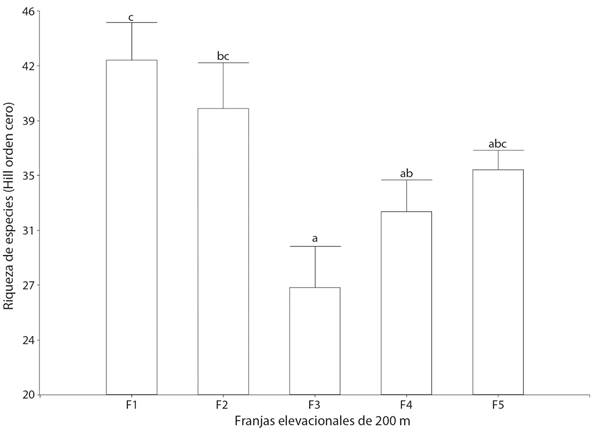
Fig. 2 Comparación de la riqueza de especies a través del gradiente elevacional. Las barras representan el error estándar. Letras diferentes indican diferencias significativas entre franjas elevacionales con una P < 0.008. F1 = 1 000-1 200 m de elevación, F2 = 1 200-1 400 m, F3 = 1 400-1 600 m, F4 = 1 600-1 800 m, F5 = 1 800-2 000 m. / Fig. 2. Comparison of species richness through the elevation gradient. The bars represent the standard error. Different letters indicate significant differences between elevation belts with a P < 0.008. F1 = 1 000-1 200 m of elevation, F2 = 1 200-1 400 m, F3 = 1 400-1 600 m, F4 = 1 600-1 800 m, F5 = 1 800-2 000 m.
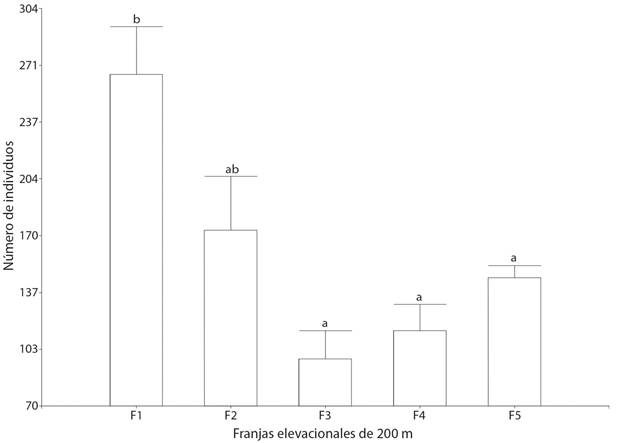
Fig. 3 Comparación de la abundancia de especies a través del gradiente elevacional. Las barras representan el error estándar. Letras diferentes indican diferencias significativas entre franjas elevacionales con una P < 0.004. F1 = 1 000-1 200 m de elevación, F2 = 1 200-1 400 m, F3 = 1 400-1 600 m, F4 = 1 600-1 800 m, F5 = 1 800-2 000 m. / Fig. 3. Comparison of species abundance through the elevation gradient. The bars represent the standard error. Different letters indicate significant differences between elevation belts with a P < 0.004. F1 = 1 000-1 200 m of elevation, F2 = 1 200-1 400 m, F3 = 1 400-1 600 m, F4 = 1 600-1 800 m, F5 = 1 800-2 000 m.
El 28 % de las especies se observaron en una FE y el 13 % se les registró en todas, de éstas últimas las que tuvieron mayores abundancias fueron Myadestes occidentalis (219 individuos), Volatinia jacarina (199), Peucaea ruficauda (195), Setophaga coronata (187), Myoboris miniatus (145) y Piranga flava (131) (Tabla 1). Nueve especies se registraron sólo en una ocasión, entre ellas Archilochus colubris, Basileuterus lachrymosus, Glaucidium gnoma y Tyrannus melancholicus (Tabla 1).
Tabla 1 Avifauna registrada con el método del punto conteo de radio ilimitado a través de un gradiente elevacional en la Reserva de la Biosfera de la Sierra de Manantlán. / Table 1. Avifauna recorded with the unlimited radius point count method through an elevation gradient in the Sierra de Manantlán Biosphere Reserve.
| Familia y especie | Acrón | End | Est | F1 | F2 | F3 | F4 | F5 | CR | Total |
| Aegithalidae | ||||||||||
| Psaltriparus minimus | Psamin | R | 8 | 20 | 7 | 35 | ||||
| Alcedinidae | ||||||||||
| Chloroceryle americana | Chlame | R | 2 | 2 | ||||||
| Cardinalidae | ||||||||||
| Passerina caerulea | Pascae | R | 57 | 54 | 111 | |||||
| Passerina ciris | Pascir | M | 5 | Pr | 5 | |||||
| Passerina cyanea | Pascya | M | 3 | 3 | ||||||
| Passerina leclancherii | Paslec | X | R | 2 | 2 | |||||
| Passerina versicolor | Pasver | R | 10 | 2 | 12 | |||||
| Pheucticus melanocephalus | Phemel | R | 18 | 12 | 30 | |||||
| Piranga bidentata | Pirbid | R | 1 | 1 | 2 | |||||
| Piranga erythrocephala | Pirery | X | R | 5 | 5 | |||||
| Piranga flava | Pirfla | R | 10 | 26 | 35 | 28 | 32 | 131 | ||
| Piranga ludoviciana | Pirlud | M | 3 | 2 | 5 | |||||
| Piranga rubra | Pirrub | M | 5 | 3 | 5 | 5 | 5 | 23 | ||
| Certhiidae | ||||||||||
| Certhia americana | Cerame | R | 6 | 33 | 49 | 88 | ||||
| Columbidae | ||||||||||
| Columbina inca | Colinc | R | 32 | 9 | 41 | |||||
| Leptotila verreauxi | Lepver | R | 31 | 51 | 1 | 4 | 87 | |||
| Patagioenas fasciata | Patfas | R | 1 | 7 | 29 | 37 | ||||
| Zenaida asiatica | Zenasi | R | 5 | 5 | ||||||
| Corvidae | ||||||||||
| Calocitta formosa | Calfor | R | 27 | 1 | 28 | |||||
| Corvus corax | Corcor | R | 1 | 4 | 4 | 2 | 11 | |||
| Cyanocorax yncas | Cyaync | R | 3 | 18 | 40 | 61 | ||||
| Cracidae | ||||||||||
| Ortalis poliocephala | Ortpol | X | R | 15 | 1 | 16 | ||||
| Penelope purpurascens | Penpur | R | 2 | 2 | A | 4 | ||||
| Cuculidae | ||||||||||
| Crotophaga sulcirostris | Crosul | R | 4 | 4 | ||||||
| Piaya cayana | Piacay | R | 4 | 11 | 15 | |||||
| Fringillidae | ||||||||||
| Euphonia affinis | Eupaff | R | 12 | 1 | 13 | |||||
| Euphonia elegantissima | Eupele | R | 8 | 3 | 11 | |||||
| Spinus psaltria | Spipsa | R | 53 | 62 | 6 | 121 | ||||
| Furnariidae | ||||||||||
| Lepidocolaptes leucogaster | Lepleu | X | R | 5 | 19 | 19 | 43 | |||
| Sittasomus griseicapillus | Sitgri | R | 3 | 3 | 1 | 7 | ||||
| Xiphorhynchus flavigaster | Xipfla | R | 4 | 3 | 1 | 4 | 5 | 17 | ||
| Icteridae | ||||||||||
| Icterus bullockii | Ictbul | M | 2 | 2 | ||||||
| Icterus cucullatus | Ictcuc | R | 5 | 5 | ||||||
| Icterus graduacauda | Ictgra | R | 2 | 8 | 27 | 37 | ||||
| Icterus pustulatus | Ictpus | R | 54 | 25 | 1 | 80 | ||||
| Icterus wagleri | Ictwag | R | 28 | 4 | 32 | |||||
| Molothrus aeneus | Molaen | R | 9 | 5 | 1 | 15 | ||||
| Mimidae | ||||||||||
| Melanotis caerulescens | Melcae | X | R | 2 | 8 | 2 | 21 | 33 | ||
| Momotidae | ||||||||||
| Momotus mexicanus | Mommex | R | 4 | 4 | 8 | |||||
| Odonthophoridae | ||||||||||
| Dactylortyx thoracicus | Dactho | R | 1 | 11 | Pr | 12 | ||||
| Dendrortyx macroura | Denmac | X | R | 9 | A | 9 | ||||
| Paridae | ||||||||||
| Baeolophus wollweberi | Baewol | R | 3 | 2 | 5 | |||||
| Poecile sclateri | Poescl | R | 3 | 3 | ||||||
| Parulidae | ||||||||||
| Basileuterus belli | Basbel | R | 23 | 23 | ||||||
| Basileuterus lachrymosus | Baslac | R | 1 | 1 | ||||||
| Basileuterus rufifrons | Basruf | R | 36 | 19 | 6 | 2 | 2 | 65 | ||
| Cardellina pusilla | Carpus | M | 6 | 7 | 2 | 11 | 50 | 76 | ||
| Cardellina rubra | Carrub | X | R | 6 | 6 | |||||
| Cardellina rubrifrons | Carrubi | M | 4 | 4 | ||||||
| Geothlypis poliocephala | Geopol | R | 3 | 5 | 8 | |||||
| Geothlypis tolmiei | Geotol | M | 5 | 1 | 1 | A | 7 | |||
| Leiothlypis ruficapilla | Leiruf | M | 2 | 4 | 1 | 7 | ||||
| Mniotilta varia | Mnivar | M | 4 | 1 | 6 | 7 | 18 | |||
| Myioborus miniatus | Myimin | R | 7 | 29 | 109 | 145 | ||||
| Myioborus pictus | Myipic | R | 25 | 48 | 18 | 25 | 116 | |||
| Oreothlypis superciliosa | Oresup | R | 3 | 9 | 10 | 20 | 42 | |||
| Parkesia motacilla | Parmot | M | 12 | 12 | ||||||
| Setophaga coronata | Setcor | R | 39 | 66 | 41 | 26 | 15 | 187 | ||
| Setophaga graciae | Setgra | R | 5 | 5 | 10 | |||||
| Setophaga nigrescens | Setnig | M | 1 | 5 | 4 | 7 | 5 | 22 | ||
| Setophaga occidentalis | Setocc | M | 1 | 4 | 7 | 12 | ||||
| Setophaga pitiayumi | Setpit | R | 1 | 1 | ||||||
| Setophaga townsendi | Settow | M | 1 | 9 | 10 | 12 | 13 | 45 | ||
| Passerellidae | ||||||||||
| Arremon virenticeps | Arrvir | X | R | 22 | 22 | |||||
| Atlapetes pileatus | Atlpil | X | R | 1 | 2 | 9 | 12 | |||
| Melozone kieneri | Melkie | X | R | 19 | 19 | 38 | ||||
| Melospiza lincolnii | Mellin | M | 13 | 13 | ||||||
| Melospiza melodia | Melmel | R | 4 | 4 | ||||||
| Peucaea humeralis | Peuhum | X | R | 7 | 4 | 11 | ||||
| Peucaea ruficauda | Peuruf | R | 174 | 21 | 195 | |||||
| Pipilo ocai | Pipoca | X | R | 15 | 15 | |||||
| Peucedramidae | ||||||||||
| Campephilus guatemalensis | Camgua | R | 8 | 4 | 4 | 2 | Pr | 18 | ||
| Colaptes auratus | Colaur | R | 2 | 5 | 7 | |||||
| Dryobates arizonae | Dryari | R | 8 | 7 | 30 | 45 | ||||
| Dryobates scalaris | Drysca | R | 23 | 24 | 14 | 61 | ||||
| Melanerpes chrysogenys | Melchr | X | R | 59 | 5 | 64 | ||||
| Melanerpes formicivorus | Melfor | R | 1 | 7 | 13 | 16 | 9 | 46 | ||
| Peucedramus taeniatus | Peutae | R | 1 | 1 | 3 | 5 | ||||
| Polioptilidae | ||||||||||
| Polioptila caerulea | Polcae | R | 32 | 16 | 12 | 4 | 64 | |||
| Psittacidae | ||||||||||
| Forpus cyanopygius | Forcya | X | R | 68 | 10 | 3 | Pr | 81 | ||
| Ptilogonyidae | ||||||||||
| Ptilogonys cinereus | Pticin | R | 58 | 3 | 30 | 1 | 2 | 94 | ||
| Regulidae | ||||||||||
| Regulus calendula | Regcal | M | 1 | 3 | 1 | 5 | ||||
| Strigidae | ||||||||||
| Glaucidium brasilianum | Glabra | R | 2 | 2 | ||||||
| Glaucidium gnoma | Glagno | R | 1 | 1 | ||||||
| Thraupidae | ||||||||||
| Saltator coerulescens | Salcoe | R | 7 | 7 | ||||||
| Sporophila torqueola | Spotor | R | 6 | 9 | 15 | |||||
| Volatinia jacarina | Voljac | R | 156 | 43 | 199 | |||||
| Tityridae | ||||||||||
| Pachyramphus aglaiae | Pacagl | R | 1 | 1 | 2 | |||||
| Tityra semifasciata | Titsem | R | 2 | 20 | 3 | 4 | 29 | |||
| Trochilidae | ||||||||||
| Archilochus colubris | Arccol | M | 1 | 1 | ||||||
| Basilinna leucotis | Basleu | R | 18 | 56 | 74 | |||||
| Cynanthus latirostris | Cynlat | R | 66 | 15 | 1 | 82 | ||||
| Eugenes fulgens | Eugful | R | 4 | 13 | 17 | |||||
| Heliomaster constantii | Helcon | R | 12 | 1 | 13 | |||||
| Lampornis amethystinus | Lamame | R | 1 | 6 | 31 | 90 | 128 | |||
| Leucolia violiceps | Leuvio | R | 46 | 8 | 54 | |||||
| Saucerottia beryllina | Sauber | R | 22 | 13 | 18 | 15 | 4 | 72 | ||
| Selasphorus calliope | Selcal | M | 2 | 2 | 4 | |||||
| Selasphorus platycercus | Selpla | R | 9 | 15 | 3 | 1 | 7 | 35 | ||
| Selasphorus rufus | Selruf | M | 1 | 1 | ||||||
| Tilmatura dupontii | Tildup | R | 1 | A | 1 | |||||
| Troglodytidae | ||||||||||
| Henicorhina leucophrys | Henleu | R | 7 | 7 | ||||||
| Pheugopedius felix | Phefel | X | R | 30 | 42 | 2 | 2 | 76 | ||
| Thryophilus sinaloa | Thrsin | X | R | 31 | 33 | 1 | 1 | 66 | ||
| Troglodytes aedon | Troaed | R | 5 | 12 | 17 | |||||
| Trogonidae | ||||||||||
| Trogon mexicanus | Tromex | R | 1 | 3 | 15 | 41 | 60 | |||
| Turdidae | ||||||||||
| Catharus aurantiirostris | Cataur | R | 2 | 1 | 1 | 2 | 9 | 15 | ||
| Catharus frantzii | Catfra | R | 1 | A | 1 | |||||
| Catharus occidentalis | Catocc | X | R | 1 | 4 | 5 | ||||
| Myadestes occidentalis | Myaocc | R | 11 | 9 | 19 | 55 | 120 | Pr | 214 | |
| Sialia sialis | Siasia | R | 58 | 14 | 72 | |||||
| Turdus assimilis | Turass | R | 11 | 2 | 1 | 10 | 33 | 57 | ||
| Turdus rufopalliatus | Turruf | X | R | 33 | 33 | |||||
| Tyrannidae | ||||||||||
| Attila spadiceus | Attspa | R | 18 | 7 | 5 | 7 | 7 | 44 | ||
| Camptostoma imberbe | Camimb | R | 15 | 11 | 2 | 28 | ||||
| Contopus pertinax | Conper | R | 11 | 16 | 17 | 21 | 31 | 96 | ||
| Megarynchus pitangua | Megpit | R | 1 | 1 | ||||||
| Mitrephanes phaeocercus | Mitpha | R | 2 | 10 | 34 | 43 | 89 | |||
| Myiodynastes luteiventris | Myilut | MV | 12 | 12 | ||||||
| Myiozetetes similis | Myisim | R | 3 | 3 | ||||||
| Myiarchus tuberculifer | Myitub | R | 6 | 2 | 1 | 9 | ||||
| Pitangus sulphuratus | Pitsul | R | 9 | 9 | ||||||
| Pyrocephalus rubinus | Pyrrub | R | 5 | 5 | 10 | |||||
| Tyrannus crassirostris | Tyrcra | R | 11 | 9 | 20 | |||||
| Tyrannus melancholicus | Tyrmel | R | 1 | 1 | ||||||
| Vireonidae | ||||||||||
| Vireo gilvus | Virgil | R | 2 | 1 | 3 | 2 | 1 | 9 | ||
| Vireo hypochryseus | Virhyp | X | R | 24 | 11 | 1 | 36 | |||
| Vireolanius melitophrys | Virmel | R | 2 | 4 | 20 | 26 | ||||
| Vireo plumbeus | Virplu | R | 3 | 7 | 2 | 12 | ||||
| Total | 1 591 | 868 | 391 | 573 | 1 165 | 4 588 |
Acrón = Acrónimo, corresponde con las tres primeras letras del género y las tres primeras de la especie; End = Endémica; Est = permanencia estacional, donde R = residente, M = migratorio y MV = migratoria de verano; F1 a F5 indican las franjas elevacionales y el número en cada una de ellas corresponde a la abundancia de la especie; CR = categoría de conservación, donde Pr = sujeta a protección especial, A = amenazada. / Acrón = Acronym, corresponds to the first three letters of the genus and the first three of the species; End = Endemic; Est = seasonal permanence, where R = resident, M = migratory and MV = summer migratory; F1 to F5 indicate the altitudinal bands and the number in each of them corresponds to the abundance of the species; CR = conservation category, where Pr = subject to special protection, A = threatened.
De las 129 especies registradas, 108 fueron residentes, 20 migratorias de invierno y una migratoria de verano (Tabla 1). Se encontraron 19 especies endémicas al territorio nacional, 44 con distribución mesoamericana, 32 neárticas, 30 tropicales y cuatro de distribución extensa. En total 13 especies se encuentran en alguna categoría de riesgo de acuerdo con la NOM-059-SEMARNAT-2010 y PIF (2019) (Tabla 1). De las endémicas al occidente de México, algunas como Forpus cyanopygius, Melanerpes chrysogenys, Melozone kieneri, Pheugopedius felix, Thryophilus sinaloa y Turdus rufopalliatus, presentaron su mayor abundancia en las F1 y F2. No se registraron especies endémicas para la F3. De las especies endémicas a las montañas de México, Lepidcolaptes leucogaster, Arremon virenticeps y Pipilo ocai registraron sus mayores abundancias en las F4 y F5.
Distribución de la avifauna a través del gradiente elevacional: El procedimiento de permutación multirespuesta encontró que todas las franjas son estadísticamente diferentes en términos de su composición y abundancia avifaunística con una δobs promedio = 0.22 una δesp = 0.50 una A = 0.55 y una P = 0.00000003. La mayor heterogeneidad avifaunística expresada como el valor de distancia promedio ponderado dentro de la franja fue para las F1 (δobs = 0.355) y F2 (δobs = 0.294) con una disminución hacia las F3, F4 y F5 (δobs = 0.196, 0.21, 0.10, respectivamente).
Se registraron 21 especies indicadoras (P ≤ 0.05), 10 para la F1, 3 para la F2 y 8 para la F5, y ninguna para la F3 y F4 (Tabla 2). Con excepción de Passerina ciris y Myiodynastes luteiventris, que son especies migratorias, todas las demas fueron residentes (Tabla 1). Tyrannidae y Cardinalidae presentaron especies indicadoras para la parte baja del gradiente elevacional (F1 y F2), mientras que Odonthophoridae, Passerellidae y Troglodytidae estuvieron presentes en la parte superior del gradiente (F5).
Tabla 2 Especies indicadoras por FE a través de un gradiente elevacional en la Reserva de la Biosfera de la Sierra de Manantlán. / Table 2. Indicator species by EB through an elevation gradient in the Sierra de Manantlán Biosphere Reserve.
| Especie | Acró | Familia | VI | Vp | F1 | F2 | F3 | F4 | F5 |
| Passerina ciris | Pascir | Cardinalidae | 50 | 0.013 | X | ||||
| Passerina versicolor | Pasver | Cardinalidae | 40.3 | 0.048 | X | ||||
| Ortalis poliocephala | Ortpol | Cracidae | 45.5 | 0.034 | X | ||||
| Piaya cayana | Piacay | Cuculidae | 61.4 | 0.006 | X | ||||
| Euphonia affinis | Eupaff | Fringillidae | 60.6 | 0.0052 | X | ||||
| Icterus cucullatus | Ictcuc | Icteridae | 50 | 0.0122 | X | ||||
| Dactylortys thoracicus | Dactho | Odonthophoridae | 54.6 | 0.0098 | X | ||||
| Dendrortyx macroura | Denmac | Odonthophoridae | 50 | 0.0196 | X | ||||
| Basileuterus belli | Basbel | Parulidae | 50 | 0.0152 | X | ||||
| Geothlypis poliocephala | Geopol | Parulidae | 40 | 0.0428 | X | ||||
| Arremon virenticeps | Arrvir | Passerellidae | 75 | 0.0016 | X | ||||
| Pipilo ocai | Pipoca | Passerellidae | 50 | 0.0198 | X | ||||
| Saltator coerulescens | Salcoe | Thraupidae | 50 | 0.0114 | X | ||||
| Heliomaster constantii | Helcon | Trochilidae | 45.5 | 0.0268 | X | ||||
| Henicorhina leucophrys | Henleu | Troglodytidae | 62.5 | 0.0026 | X | ||||
| Troglodytes aedon | Troaed | Troglodytidae | 52.5 | 0.0066 | X | ||||
| Myiarchus tuberculifer | Myitub | Tyrannidae | 41.7 | 0.0374 | X | ||||
| Myiodynastes luteiventris | Myilut | Tyrannidae | 66.7 | 0.0032 | X | ||||
| Myiozetetes similis | Myisim | Tyrannidae | 50 | 0.0144 | X | ||||
| Pitangus sulphuratus | Pitsul | Tyrannidae | 83.3 | 0.0004 | X | ||||
| Vireolanius melitophrys | Virmel | Vireonidae | 57.6 | 0.0022 | X |
Acrón = Acrónimo, corresponde con las tres primeras letras del género y las tres primeras de la especie; VI = valor de importancia; Vp = valor de probabilidad; F1 a F5 indican las franjas elevacionales. / Acrón = Acronym, corresponds to the first three letters of the genus and the first three of the species; VI = importance value; Vp = probability value; F1 to F5 indicate the elevational belts.
La ordenación con Escalamiento Multidimensional No Métrico (NMS) obtuvo como solución una dimensión, la cual extrajo el 92.3 % de la varianza atribuible a las especies, con un estrés de 10.74 a las 44 iteraciones y una P = 0.019. En el espacio dimensional se localizan en el extremo izquierdo de la ordenación los PCF y las especies de aves a menor elevación, en la parte media los PCF y las aves con distribución en la parte media del gradiente elevacional y en el extremo derecho los PCF a mayor elevación y las especies que se distribuyen principalmente en la parte alta del gradiente (Fig. 4). Los primeros seis puntos de observación corresponden a la F1, en el que un conjunto de especies de aves se relacionó con esta parte del gradiente, entre las cuales sobresalen por su abundancia Cynanthus latirostris, Forpus cyanopygius, Melanerpes chrysogenys, Passerina leclancherii, Peucaea ruficauda, Sialia sialis y Volatinia jacarina; en el extremo derecho de la ordenación se localizaron los puntos de observación y las especies con mayor abundancia en los PCF de las F4 y F5, entre las que destacan Basilinna leucotis, Cardellina pusilla, Lampornis amethystinus, Mitrephanes phaeocercus, Myadestes occidentalis y Myoborus miniatus (Fig. 4).

Fig. 4 Relación entre los puntos de conteo fijos y las especies a través del gradiente elevacional. Los rombos representan los puntos conteo fijos y los acrónimos las especies (ver Tabla 1). / Fig. 4. Relationship between fixed counting points and species through the elevation gradient. The diamonds represent the fixed counting points and the acronyms the species (see Table 1).
Discusión
Las 129 especies de aves que se registraron en el gradiente elevacional, representan el 38 % de la avifauna de la RBSM y el 22 % del estado de Jalisco (Instituto Nacional de Ecología, 2000; Santana et al., 2017). Esta riqueza de especies es menor a lo consignado por Medina-Macías et al. (2010), lo cual se atribuye a que el gradiente elevacional estudiado por ellos es 1 500 m más largo. Las familias con mayor riqueza de especies (Parulidae, Trochilidae, Tyrannidae y Cardinalidae) coinciden con las registradas como tal en otras localidades de México y el occidente de México (Bojorges-Baños & López-Mata, 2006; Martínez & Rechberger, 2007; Santana et al., 2017; Santana et al., 2020).
Las curvas de interpolación y extrapolación separaron las F1 y F2 cómo las más ricas en especies de aves, por lo que podría aseverarse que esta parte del gradiente ambiental presenta los valores mayores para este atributo con una disminución hacia la parte superior del gradiente F3-F5 (Fig. 1). Este resultado fue consistente con la prueba no paramétrica de Kruskall-Wallis para la riqueza de especies. Las diferencias en el patrón de distribución de la riqueza de las especies se atribuyen a la heterogeneidad del paisaje en el gradiente estudiado, siendo la más importante la variación en los tipos de hábitats expresados a través de las comunidades vegetales, lo cual ha sido registrado de influencia en la riqueza de especies de aves (Jaime-Escalante et al., 2016; Navarro-Sigüenza, 1992; Santana et al., 2020). La F1 y la F2, las de mayor riqueza de especies de aves, coinciden con la presencia de BTC, un tipo de vegetación con alta riqueza de especies de plantas y estructuralmente compleja, lo cual se ha correlacionado con mayor riqueza de aves (Almazán-Núñez et al., 2007; Bojorges-Baños & López-Mata, 2006; MacArthur & MacArthur, 1961; Santana et al., 2020). La abundancia de individuos a través de las franjas elevacionales presentó un patrón consistente con el de la riqueza de especies, con una mayor concentración en la F1 y F2 y una disminución en las F3-F5, aunque sólo fue estadísticamente diferente la F1 con las F3-F5. Este resultado también fue acorde con lo encontrado a través de la correlación. Este comportamiento podría atribuirse a las razones ya explicadas que podrían estar influyendo en los patrones de la distribución de la riqueza de especies a través del gradiente elevacional.
Especies que sólo fueron registradas en una ocasión, podría deberse a que algunas de ellas son de tamaños pequeños y poco audibles como Archilochus colubris, Tilmatura dupontii, además que han sido consideradas como especies raras, esta última condición la comparten con Glaucidium gnoma (Bojorges-Baños & López-Mata, 2006; Contreras-Martínez, 1992; Howell & Web, 1995; Santana, 2000). Otras como Basileuterus lachrymosus y Setophaga pitiayami, registradas principalmente en lugares tropicales y húmedos, no encuentran hábitat apropiado en el gradiente estudiado, mientras que Megarynchus pitangua, Selasphorus rufus y Tyrannus melancholicus, son especies audibles y comunes en la región, sin embargo, se necesita una mayor investigación para explicar su baja detección en el gradiente.
Las especies con mayores abundancias como, Myadestes occidentalis, Volatinia jacarina, Peucaea ruficauda, Setophaga coronata, Myoborus miniatus y Piranga flava (Tabla 1), coinciden con lo encontrado en otras investigaciones en la región (Santana, 2000) y también ya han sido registradas entre las especies más abundantes en zonas boscosas con condiciones similares a las estudiadas (Almazán-Núñez et al., 2009; Contreras-Martínez, 1992; Navarro-Sigüenza, 1992; Tinajero, 2005).
El porcentaje de especies de aves endémicas registradas, equivalen al 41% de la RBSM y al 10 % de las endémicas de México. El patrón de distribución de la riqueza del grupo, a través del gradiente, es similar en la parte baja y alta, pero diferente en composición, lo cual coincide con otras investigaciones (Contreras-Martínez et al., 2017; Navarro-Sigüenza et al., 2014; Santana et al., 2020), aunque en algunas investigaciones se ha registrado una mayor riqueza de endemismo por arriba de los 1 800 m (González-García & Gómez de Silva, 2002; Martínez & Rechberger 2007), lo cual no fue posible corroborar dado que el límite de nuestro gradiente no difirió mucho de esa elevación. La distribución de las especies de aves en alguna categoría de riesgo se mantiene a través del gradiente elevacional, patrón similar a lo registrado por Martínez y Rechberger (2007), lo cual se atribuye a la pérdida de hábitat, fragmentación y perturbaciones más o menos comunes en todas las áreas.
Los resultados del MRPP encontraron que en composición avifaunística y sus abundancias, las cinco FE fueron estadísticamente diferentes, lo que es acorde con lo encontrado en otras investigaciones, de un fuerte recambios de especies, aun en distancias verticales cortas (Martínez & Rechberger, 2007). La razón de que la mayor heterogeneidad dentro de las FE se registró para la F1 y F2, era lo esperado ya que fueron las FE con mayor riqueza y abundancia de especies, lo que implica una mayor heterogeneidad dentro de los PCF de cada FE que se expresa en una δobs mayor (F1 = 0.355, F2 = 0.294). Esta mayor heterogeneidad en las F1 y F2 podría ser atribuida a la presencia de BTC, un tipo de vegetación con alta riqueza de especies de plantas y estructuralmente compleja, que se expresa en mayor variación de hábitats, que permite una mayor riqueza de aves (Almazán-Núñez et al., 2007; Bojorges-Baños & López-Mata, 2006; MacArthur & MacArthur, 1961; Santana et al., 2020).
El registro de especies indicadoras para las FE (Tabla 2), se interpreta como el resultado de que las frecuencias y abundancias de algunas especies atienden a preferencias ambientales, que se registran en las diferentes FE. Las especies registradas como indicadoras correspondieron en general con aquellas con abundancias bajas y que sólo fueron encontradas en uno o algunos de los PCF de una FE. El que se hayan concentrado las especies indicadoras en la F1 y la F5 es indicativo de una mayor diferensiación ambiental con la distancia vertical entre las especies. Arremon virenticeps, Dendrortyx macroura, Pipilo ocai y Troglodytes aedon, indicadoras de la F5, ya han sido reconocidas como especies con preferencia por las zonas subtropicales y templadas (Favela et al., 2018), mientras que otras como Euphonia affinis, Geothlypis poliocephala, Heliomaster constantii, y Pitangus sulphuratus, indicadoras de la F1, se ha hecho notar su preferencia por ambientes tropicales secos (Abad-Ibarra et al., 2008; Monroy, 2010; Ramírez-Albores et al., 2016; Rios-Saldaña & Rios-Saldaña, 2013). El que no se hayan registrado especies indicadoras para la F3 y F4, podría deberse a que se trata de la zona de transición entre lo tropical y templado, por lo cual algunas especies marcan su distribución tropical y otras su distribución templada, por lo cual son especies que se comparten unas con la parte baja y otras con la parte alta del gradiente elevacional.
La ordenación con NMS en función de la composición y la abundancia de especies, extrajo en una sóla dimensión más del 90 % de la varianza de las especies. En esta dimensión por la distribución de los PCF y de las especies se deduce un gradiente ambiental que corresponde con la elevación, como se aprecia en la figura 4. En la parte baja del gradiente, F1 y F2, se presenta un conjunto de especies que tienen como principal hábitat el BTC. La composición de las especies va cambiando en función de cambios en la elevación, hasta llegar a la parte más alta del gradiente elevacional, con especies que se les ha registrado principalmente en el bosque de pino-encino y pino. Las especies en la parte baja del gradiente como P. ruficauda y V. jacarina y las endémicas M. chrysogenys, P. leclancherii, T. rufopalliatus y Vireo hypochryseus, ya han sido registradas en condiciones similares de hábitat (Vázquez-Reyes et al., 2017; Vega-Rivera et al., 2010). Especies encontradas entre los 1 600-2 000 m de elevación (F4 y F5), como Catharus frantzii, Dactylortyx thoracicus, Dendrortyx macroura y Penelope purpurascens, coinciden con las que han sido consideradas como de bosques templados (Contreras-Martínez, 1992; Navarro-Sigüenza, 1992). Entre los 1 200-1 600 m (F2 y F3), la composición y abundancia de las especies es coincidente con lo encontrado en otras investigaciones, y se registran recambios de especies del mismo género, que indican transición entre las zonas tropicales y templadas, entre las que de acuerdo con nuestra investigación sobresalen Dryobates scalaris-D. arizonae, Tyramnus crassirostris-T. melancholicus, Vireo plumbeus-V. melitophrys.
La mayor riqueza y abundancia de especies de aves se registra en la parte baja del gradiente elevacional. Las FE fueron diferentes en la composición y abundancia avifaunistica, lo que implicó un cambio en la composición de las especies en distancias verticales cortas, siendo esta composición más heterogénea en las F1 y F2. El endemismo en número de especies se mantiene a través del gradiente elevacional, aunque cambian las especies a través de él. Los patrones de distribución de riqueza y abundancia de las especies, así como los cambios en su composición a través del gradiente elevacional, fue coincidente con la distribución de comunidades vegetales a través de la elevación. Las hipótesis planteadas para la investigación se corroboran al registrase una disminución de la riqueza de especies de aves con el incremento de la elevación y la formación de grupos de especies expresados a través de FE estadísticamente diferentes en su composición y abundancia de especies. Para un mejor entendimiento de los patrones de la riqueza, abundancia y composición de la avifauna en la zona, se recomienda ampliar el estudio para cubrir un gradiente elevacional más amplio en la RBSM (400-2 850 m).
Declaración de ética: los autores declaran que todos están de acuerdo con esta publicación y que han hecho aportes que justifican su autoría; que no hay conflicto de interés de ningún tipo; y que han cumplido con todos los requisitos y procedimientos éticos y legales pertinentes. Todas las fuentes de financiamiento se detallan plena y claramente en la sección de agradecimientos. El respectivo documento legal firmado se encuentra en los archivos de la revista.












 uBio
uBio 


