Revista de Biología Tropical
versión On-line ISSN 0034-7744versión impresa ISSN 0034-7744
Rev. biol. trop vol.47 no.3 San José sep. 1999
(Cyprinodontiformes: Poeciliidae) en la Laguna "El Rodeo",
Morelos, México
José Luis Gómez-Márquez José Luis Guzmán-Santiago Alberto Olvera-Soto 1
Recibido 11-VIII-1998. Corregido 11-I-1999. Aceptado 15-I-1999.
Abstract
We studied reproduction and growth of Heterandria bimaculata in "El Rodeo" lake Morelos, Mexico, from December 1986 through December 1987. A total of 1 452 specimens were obtained (monthly samples). Females represented 60.12 %, males 34.98 % and the young 4.89 % of the population. Overall sex ratio was 1.7: 1 in favor of females (p<0.05). The size at first reproduction for females was 27 mm and for males 22 mm (standard lengths); multiple spawning occured throughout the reproductive cycle (from March through May and July through October) primarily, during the rainy season. There was evidence of breeding activity throughout the year. In July the gonadosomatic index mean was highest (4.7%). The number of embryos in the ovaries were between 5 and 78, with a mean fertility of 23, the fertility was associated with standard length with determination coefficients above 93.22 percent. There was a direct relationship between specimen length and weight, and the asymptotic size for males was 64 mm and for females 81 mm (standard lengths).
Key words
Heterandria bimaculata, sex ratio, fertility, growth, Morelos.
Los poecílidos, peces nativos del nuevo mundo y de distribución principalmente tropical, comprenden alrededor de 190 especies, clasificadas en 22 géneros y 12 subgéneros y son considerados como un grupo monofilético (desde el punto de vista cladista). Se distribuyen en agua dulce, salobre y marina desde el noreste de los Estados Unidos hasta el sur del Río de la Plata en la parte norte de Argentina, con gran diversificación taxonómica en America Central, México y las Indias Occidentales (Parenti & Rauchenberger 1989).
A nivel internacional, la afición por los peces ornamentales es una industria multimillonaria y los Estados Unidos de Norteamérica (E.E.U.U.) han sido considerado como el mayor mercado de peces ornamentales en el mundo, ya que de 1989 a 1992, casi el 79% de estos peces fueron importados del sureste de Asia y Japón, siendo Singapur, Filipinas, Hong Kong e Indonesia las principales naciones exportadoras. En 1992, en los E.E.U.U. se importaron 201 millones de peces (valuados en $44.7 millones), de los cuales 730 especies eran de agua dulce y 809 de origen marino (Chapman et al. 1997).
El "guatopote manchado" Heterandria bimaculata (Heckel 1848) es originario de América Central (Rosen & Bailey 1963) y se encuentra en la Vertiente del Atlántico cuyo límite norte es incierto, pero no se extiende a la cuenca del Río Nautla; se distribuye en los ríos Misantla, Blanco, Papaloapan, Coatzacoalcos y Sarabia, siendo este su límite sur en el Estado de Oaxaca, México, en elevaciones que van desde cerca del nivel del mar hasta al menos 1 430 m (Miller 1974). Se registró por primera vez a H. bimaculata en la Vertiente del Pacífico (Gaspar-Dillanes 1987) y es considerada como una especie introducida en la cuenca alta del Río Balsas (Espinoza et al. 1993) en ríos como el Amacuzac, Yautepec y Tembembe, así como en el Vaso de "El Rodeo" y la laguna de Coatetelco, Morelos, en temperaturas que oscilan de 22.0 a 28.4 °C y altitudes entre 950 y 1 500 m (Gaspar-Dillanes 1987). Esta especie también fue registrada en los canales de Xochimilco, en el Valle de México (Espinoza et al. 1993).
A pesar de su amplia distribución geográfica con otros miembros de la familia (Xiphophorus helleri, Poeciliopsis gracilis y Poecilia sp), aspectos relacionados con la biología de H. bimaculata de la laguna de "El Rodeo" son escazos, por lo cual el propósito de este artículo es obtener información sobre reproducción y crecimiento de H. bimaculata en un embalse de la cuenca del Río Balsas.
Materiales y Métodos
Se efectuó un muestreo mensual de diciembre de 1986 a diciembre de 1987 en la laguna "El Rodeo", municipio de Miacatlán, Estado de Morelos (18° 46 30" N y 99° 19 45" W) y una descripción detallada de los factores físicos y químicos del embalse es proporcionada por Alejo et al. (1989). Se capturaron 1 452 peces, con un chinchorro playero de 30 m de largo, 1.5 m de ancho y 0.01 m de luz de malla. Las muestras se colocaron en bolsas negras de polietileno con formaldehído al 4% neutralizado con borato de sodio. Asimismo, se tomaron muestras de agua de manera mensual para el registro de la temperatura ambiental y del agua (termómetro de ± 1°C), oxígeno disuelto (Winkler, modificación de azida de sodio), pH (potenciómetro de campo), alcalinidad total (titulación con ácido debil) y dureza total (método complejométrico) por medio de técnicas convencionales (Anónimo 1980). En el laboratorio, a cada espécimen se le realizó la siguiente biometría: longitud patrón (Lp) con un vernier de 0.1 mm de precisión, peso total (Pt), peso eviscerado (Pe) y peso de la gónada para hembras (Pg) con un balanza granataria de 0.1 g de precisión.
Los estadios de desarrollo gonádico se establecieron por medio de la inspección de la gónada siguiendo los criterios de Mendoza (1962) y Contreras-Mac Beath & Ramírez (1996). Se obtuvo la longitud patrón promedio y su desviación estándar (d.s.) mensual, con el fin de analizar el comportamiento del crecimiento anual por sexo. Dicho crecimiento por sexos fue comparado por medio de la prueba de t-student (p<0.05). La proporción sexual se analizó para toda la población de manera mensual y el grado de significancia de los resultados obtenidos fue establecido por medio de la ji-cuadrada () con p<0.05. Para conocer el tamaño de la primera reproducción de las hembras, se examinaron las gónadas de acuerdo al criterio empleado por Reznick & Miles (1989). Para los machos se consideró la talla cuando la estructura del gonopodio se encontraba completamente desarrollada. Se obtuvo la relación longitud patrón-peso total mediante la expresión propuesta por Ricker (1975) y se le aplicó el ANCOVA para determinar si existian similaridades entre sexos. Se obtuvieron los valores promedio y la desviación estándar de manera mensual del Indice Gonadosomático (IGS) para las hembras, el cual fue considerado como una medida del costo reproductivo de la especie (Vargas & de Sostoa 1996). La fertilidad de acuerdo a Schoenherr (1977), se obtuvo por conteo directo del número de embriones (Ne) en cada gónada antes del parto y se relacionó con la longitud patrón. Se calculó el factor de condición (FC) por medio de la fórmula de Fulton (Tesch 1968) para ambos sexos y se aplicó la pueba de Kruskal-Wallis (p<0.05), para determinar si la condición era diferente entre los sexos y de manera mensual. Asimismo, se realizó el análisis de distribución de frecuencia de tallas por medio de la modificación al método de Bhattacharya (Pauly & Caddy 1985) y para conocer el ritmo de crecimiento se utilizó el modelo de crecimiento de von Bertalanffy en la forma propuesta por Barlow (1992). Los valores de L
y k se establecieron por medio del gr·fico de Gulland (1964; citado en Pauly 1983).
Resultados
El total de ejemplares capturados fue de 1 452, con longitud patrón de 14 a 69 mm y peso total de 0.25 a 62.5 g para toda la población. En diciembre de 1986 (Cuadro 1) se capturaron 410 ejemplares (29.69%) mientras que en mayo se colectaron solo 30 peces (2.17%). Del total de organismos examinados 71 (4.89 %) fueron indeterminados, 873 (60.12%) correspondieron a hembras y 508 (34.98%) a machos, lo cual da una proporción sexual hembra: macho de 1.7: 1 ( p<0.05). La variación mensual en dicha proporción mostró que las hembras prevalecieron a través del año excepto en marzo, donde se observó una mayor proporción de machos (0.55: 1). La dominancia de hembras se registró en mayo, a razón de 3.28: 1 hembra: macho. En octubre y diciembre de 1987 la proporción de los sexos parece ser no diferir significativamente de 1: 1 (hembra: macho).
Resultados de para el análisis de las frecuencias absolutas mensuales
de hembras y machos de H. bimaculata.
| | | (h) | (m) | |
| |
| Diciembre 86 | | | | | | |
| Enero 87 | | | | | | |
| Marzo | | | | | | |
| Abril | | | | | | |
| Mayo | | | | | | |
| Junio | | | | | | |
| Julio | | | | | | |
| Agosto | | | | | | |
| Septiembre | | | | | | |
| Octubre | | | | | | |
| Noviembre | | | | | | |
| Diciembre | | | | | | |
| Total | | | | | | |
* =p<0.05; ns = no significativa; gl = 1
Se encontró dimorfismo sexual en las características morfológicas de H. bimaculata. El principal carácter que distingue a los machos de las hembras es la modificación de los radios de la aleta anal, que en los machos forma el gonopodio. La talla entre los sexos es diferente (Cuadro 2), ya que las hembras alcanzan tallas más grandes (69 mm de Lp) que los machos (60 mm de Lp; t-student p<0.05). No se presentan diferencias en cuanto al color, pero las hembras son más brillantes.
Estadísticas descriptivas de H. bimaculata.
| | | |||||
| Parámetro | | | | | | |
| Lp (mm) | | | | | | |
| Pt (g) | | | | | | |
| Pe (g) | | | | | | |
| Ne | | | | |||
Lp=longitud patrón; Pt=peso total; Pe=Peso eviscerado; Ne=número de embriones; d.e.= desviación estándar
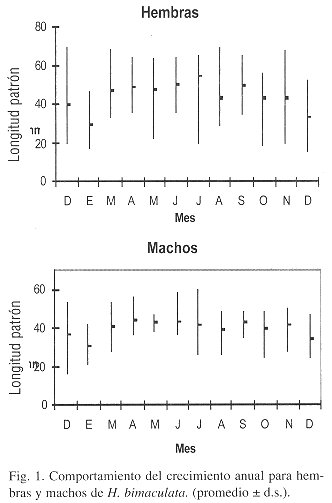
La longitud patrón promedio mensuales y sus respectivos valores mínimos y máximos (Fig. 1) muestran una variación estacional para ambos sexos (Kruskal-Wallis p<0.05). En las hembras principalmente, se observa que de marzo a julio hay un incremento notable en la talla, el cual corresponde con el aumento en la temperatura ambiental y del agua durante este período y, de agosto a enero una disminución del crecimento debido al proceso reproductivo, a la presencia de juveniles así como a las condiciones ambientales presentes. El mismo comportamiento se registró para los machos, aunque con tallas promedio menores a las hembras.
Se detectó diferencia en el tamaño del inicio de la reproducción entre los sexos (t-student p<0.05) y de acuerdo al criterio empleado, la longitud patrón a la cual se inicia la primera reproduccion para los hembras de H. bimaculata fue de 27 mm. En los machos, el espécimen más pequeño con el gonopodio completamente formado fue de 22 mm.
Al realizar la relación entre la longitud patrón y el peso total para ambos sexos se encontraron diferencias significativas (ANCOVA p<0.05) para este gradiente de crecimiento. Para una misma longitud patrón, las hembras fueron más pesadas que los machos y la relación potencial indicó que el tipo de crecimiento que presentaron los machos es alométrico negativo mientras que las hembras presentaron un comportamiento alométrico positivo. Las ecuaciones quedaron establecidas de la siguiente manera:
Pt = 0.0017 Lp 3.02; r2 = 96.39 %; n = 837; (hembras)
Pt = 0.0020 Lp 2.97; r2 = 90.09 %; n = 484; (machos)
La alta proporción de estadios de maduración gonádica en las hembras (Fig. 2), representativos de la reproducción (estadíos de desarrollo IV y V) estuvieron presentes casi todo el año, con mayor porcentaje de marzo a mayo y de julio a octubre, lo cual coincide para este último período con la época de lluvias. El estadío VI estuvo ausente en mayo, agosto y septiembre, mientras que el estadío I estuvo presente en mayor proporción desde agosto hasta enero y durante el resto del tiempo presentó bajos porcentajes. El estadío II se registró casi todo el año pero con bajos valores. Respecto al estadío III, este se observó de abril a junio y posteriormente de agosto a noviembre. En los machos no fue posible establecer los estadíos de maduración debido a que todas las gónadas se encontraban maduras.
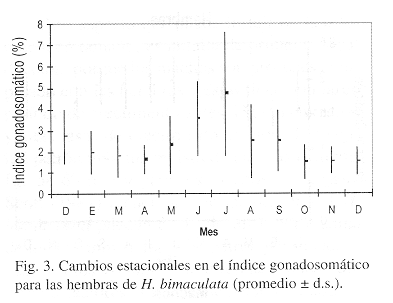
En julio se registró el valor más alto del indice gonadosomático (4.7%) para las hembras y a partir de este mes se observó la tendencia de disminución hasta abril, con el consecuente incremento posteriormente (Fig. 3), cuando aumenta la temperatura ambiental y del agua (r=0.5916, Fig. 7). Este resultado revela, el período de reproducción para la especie y además es durante estos meses cuando se produce la mayor cantidad de embriones, aunque por los datos de maduración gonádica es probable que se registren todo el año, pero en menor cantidad.
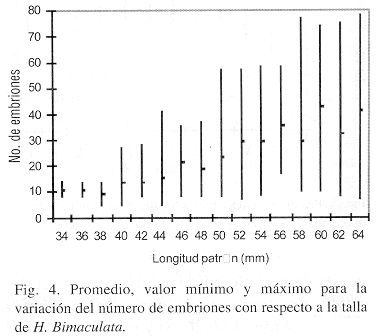
Respecto a la fertilidad, se analizaron las gónadas de 206 hembras cuyo número de embriones fluctuó entre 5 y 78 con un promedio de 23. Al relacionar la talla de las hembras con el número de embriones (Fig. 4) se observa que conforme esta incrementa, se presenta un aumento en el número de embriones, aunque con mayor variabilidad en las tallas grandes. Así, para la talla de 34 mm de longitud patrón el número de embriones osciló entre 8 y 13 con media de 10 y para la talla de 56 a 64 mm, el promedio fue de 40 embriones. Del análisis de regresión entre la fertilidad y la longitud patrón (n=206) se obtuvo que el coeficiente de determinación fue de 93.22 %, lo cual indica que el número de embriones parece ser influenciado por el tamaño de la hembra. Dicha expresión quedó de la siguiente forma:
F = 0.0005 Lp 2.71; r2 = 93.22 %
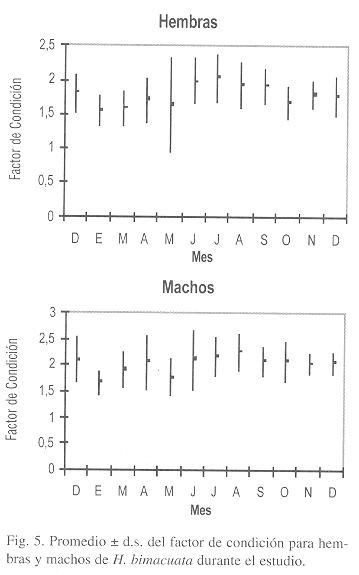
El factor de condición mostró diferencias significativas entre los sexos (Kruskal-Wallis p<0.05) con valores y patrón similar para ambos sexos. El valor máximo promedio se registró en julio (Fig. 5), como consecuencia del incremento en peso y posteriormente, la condición disminuye de agosto hasta marzo debido a la liberación de los embriones en las hembras. En enero se obtuvo el mínimo valor de condición para ambos sexos y se observó que este factor no se relaciona estadísticamente con la temperatura de agua (r2=17.59%), pero sí en cuanto al comportamiento anual que ésta presenta.
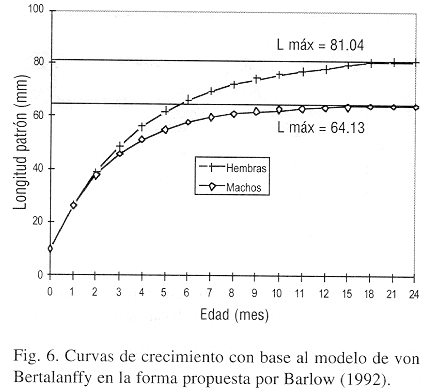
Mediante el análisis de la distribución de frecuencias de tallas, se obtuvieron cuatro clases de talla para cada uno de los sexos y con los valores de longitud patrón promedio, se calcularon la longitud asintótica y el coeficiente de crecimiento para las hembras (L=81.14 mm; k=0.2618) y para los machos (L
=64.15 mm; k=0.3579) para así generar el gráfico de crecimiento (Fig. 6), en el cual se observa que a los seis meses de edad las hembras alcanzan el 80% de su longitud asintótica, mientras que los machos el 86% debido a que las hembras parece ser viven mayor tiempo que los machos en función de la tasa de crecimiento (t-student p<0.05).
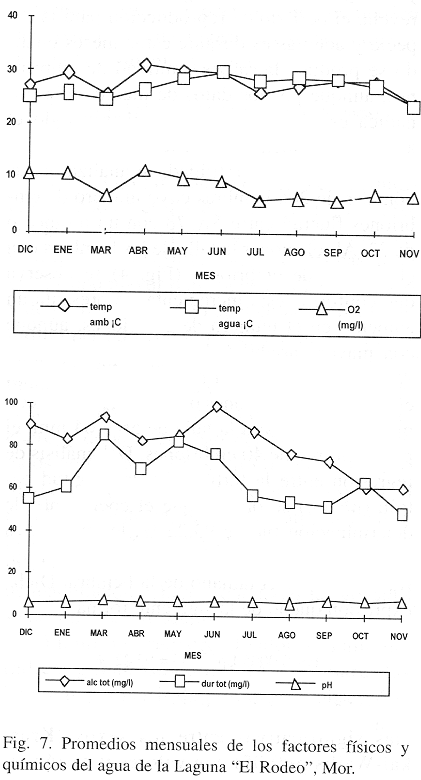
Los valores promedio de los factores físicos y químicos considerados en el estudio se encuentran representados en la Fig. 7. La temperatura del agua fluctuó entre 23.6 °C (en noviembre) y 29.2 °C (en junio) con promedio de 26.2 °C; el oxígeno disuelto presentó su máxima concentración en los meses de estiaje (abril a junio) entre 10.0 y 11.5 mg/l y la menor concentración (5.5 mg/l) en los meses de inundación (de julio a noviembre); la dureza total siguió el mismo comportamiento que el oxígeno disuelto y varió entre 49.4 y 85.2 mg/l; la alcalinidad total presentó su máximo en marzo (97.8 mg/l) y el mínimo en noviembre (61.0 mg/l) y, el pH osciló entre 6.5 y 8.3 unidades hacia el final del estudio. Estos factores se encuentran entre los valores reportados para la familia Poeciliidae.
Discusión
La mayor captura de peces (abundancia relativa) se obtuvo en julio y agosto (verano), diciembre y enero (invierno), mientras que en mayo (primavera) y de septiembre a noviembre (otoño) se recolectó la menor cantidad de organismos, lo cual se debe posiblemente a la época reproductiva que realiza la especie, ya que aunque el máximo de la etapa reproductiva se realiza de julio a septiembre, la reproducción por parte de algunas hembras continúa a través de todo el año y el reclutamiento de los peces jóvenes parece ser independiente de la estación del año. Asimismo, el arte de pesca utilizado (principalmente la luz de malla), también influye en la cantidad de peces capturados, debido a que no se pudo determinar con mayor precisión los meses en los cuales se realiza el reclutamiento, denotado por la presencia de un nuevo cohorte formado por juveniles.
Observaciones realizadas durante el estudio, revelan que H. bimaculata es una especie monomórfica con diferencias sexuales secundarias bien marcadas en tamaño y por la presencia del gonopodio en los machos, característica compartida por todos los poecílidos. Farr (1989) menciona que el tamaño diferencial en esta familia puede ser explicado en términos de que las hembras toman más tiempo en madurar y continúan creciendo a través de toda su vida. En el caso de los machos, es probable que esto sigan el comportamiento presentado por Gambusia holbrooki, ya que de acuerdo a Vargas & de Sostoa (1996) los machos no crecen o si lo hacen (Snelson 1984), éste es muy poco, una vez que el gonopodio ha sido completamente formado y no viven mucho después de haber madurado.
Otro aspecto que puede influir en la diferencia en tamaño, es la talla de primera reproducción, porque los machos son precoces comparado con las hembras y estas tienen un largo período de crecimiento antes de la maduración y altas tasas de crecimiento. Aunque la longitud patrón máxima registrada para las hembras fue de 69 mm y para los machos de 60 mm, Scott (1987) menciona que las hembras de H. bimaculata pueden alcanzar tallas por encima de los 150 mm de longitud patrón y los machos mayor a los 70 mm. Esta diferencia puede deberse a factores como alimentación (calidad y cantidad), depredación, área de captura y aspectos relacionados con la reproducción.
Respecto a la proporción sexual de la especie, de manera global esta favoreció a las hembras sobre los machos con una relación 1.7: 1. Reza & Díaz (1994) encontraron para H bimaculata una proporción de 2.3: 1 (hembras y machos) un poco mayor a la reportada para este estudio. Contreras-McBeath & Ramírez (1996) citan que P. gracilis presentó una proporción de 4.5: 1 en favor de las hembras. Dichos resultados fueron obtenidos para las especies citadas en la cuenca del Río Balsas, Mor., México. Snelson (1989) menciona que las poblaciones silvestres de los adultos de muchos poecílidos, está sesgada en favor de las hembras y que dicho sesgo es el resultado de una mortalidad diferencial entre los sexos, ya que las hembras tienen altas tasas de sobreviviencia debido a su gran tamaño, peso y color menos conspicuo que el de los machos. Esta alta mortalidad en los machos se puede deber posiblemente a la depredación, principalmente por los colores brillantes al realizar sus activiades de cortejo y otra explicación sería por la luz de malla del arte utilizado, la cual tal vez permita pasar a través de la red a los machos que por lo general son más pequeños que las hembras.
Vargas & de Sostoa (1996) reportan sesgo en favor de las hembras para G. holbrooki; y describen que ocurre cuando la proporción sexual favorece a los machos y cuando esta no difiere significativamente de 1: 1 (hembras: machos), lo cual parece suceder con la especie en estudio. Se piensa que la variación mensual en la proporción sexual refleja la dinámica natural de la población, aunque ésta esté sesgada por el tipo de muestreo, principalmente cuando aumenta el volumen de la laguna (durante los meses de lluvia), lo cual dificulta la captura de los peces en las áreas (pedregosas y alta densidad de vegetación) donde éstos se encuentran.
Con base en la variación de los estadios gonádicos durante el año, el máximo valor del índice gonadosomático obtenido para las hembras, al comportamiento del factor de condición para ambos sexos y a la presencia de embriones en las gonadas totalmente desarrollados, se detectó que el máximo período de reproducción se realiza en julio-septiembre (verano), durante la estación lluviosa, cuando la laguna comienza a incrementar su volumen y se presentan los valores más altos de temperatura, aunque parece evidente con los datos de madurez gonádica que esta actividad se realiza casi todo el año, pero en menor porcentaje como lo menciona Constantz (1989) y Meffe & Snelson (1989); esto mismo apoyado por Reza & Díaz (1994). Contreras-McBeath & Ramírez (1996) citan que P. gracilis se reproduce en el Río Cuautla, Mor. también durante la estación lluviosa (agosto y septiembre). Este patrón como lo citan Rosen & Bailey (1963), se debe a que en las zonas templadas y subtropicales el ciclo reproductivo de los poecílidos disminuye al final del verano y otoño y termina en invierno, característica que es atribuída a fluctuaciones en el fotoperíodo y a la temperatura media.
La talla a la cual los machos inician su etapa reproductora es aproximadamente a los 22 mm de longitud patrón y las hembras aproximadamente a los 27 mm, debido a que la tasa de crecimiento es mayor en los machos que en las hembras como respuesta al comportamiento reproductivo, es decir, un organismo que alcance más talla tendrá mayor oportunidad de competir en eventos reproductivos que los machos que sean de menor talla (Sumner et al. 1994). Hubbs & Mosier (1985) mencionan que las hembras de G. gaigei inician su reproducción entre los 24-25 mm de longitud patrón y en el caso de G. hurtadoi, una hembra de 20 mm de longitud patrón se encontraba en reproducción.
Se encontró que para H. bimaculata la fertilidad presentó alta asociación con la longitud patrón, resultado similar a lo reportado por otros autores para poecílidos que no presentan superfetación, ya que una hembra adulta puede liberar varias camadas en la misma temporada reproductiva pero las camadas no se sobreponen, como sucede en G. gaigei (Hubbs & Mosier 1985), Poecilia picta (Reznick et al. 1992), Poeciliopsis turrubarensis (Cabrera & Solano 1995) y G. holbrooki (Vargas & de Sostoa 1996), en las cuales se observa que un incremento en la longitud patrón esta asociado a un aumento en el número de embriones (Reznick & Miles 1989), además el tamaño de la camada varía con el tamaño de la hembra, la estación del año así como con el hábitat. Esta misma tendencia es reportada por Reza & Díaz (1994) para H. bimaculata sin mencionar el número de ejemplares que se utilizaron para la relación y el grado de asociación que se obtuvo. Respecto al número de embriones, Scott (1987) menciona que ésta especie puede producir más de 100 embriones a intervalos de seis a ocho semanas, por lo que el registro para este estudio fue mucho menor.
El tipo de crecimiento alométrico positivo, es decir, mayor crecimiento en peso que en longitud que presentan las hembras, se debe a que estas alcanzan tallas más grandes que los machos, porque éstas utilizan más tiempo para madurar, siguen creciendo en mayor porcentaje que los machos durante toda su vida y porque incrementan en peso debido al proceso reproductivo. Por otra parte, el peso que las hembras alcanzan puede ser afectado inicialmente por el número y tamaño de los ovocitos en las gónadas y posteriormente por los embriones, es decir, que a mayor talla de las gónadas aumenta el peso corporal de los individuos (Tesch 1968) o que el mayor tamaño de las hembras permite un mayor número de ovocitos y posiblemente mayor tamaño de cada uno de los embriones.
La influencia de las condiciones ambientales y la reproducción fueron reflejadas en la condición de H. bimaculata. El máximo valor del factor de condición se registró en julio, el cual coincidió con valores altos de temperatura, aumento en el peso debido al crecimiento de los embriones dentro de las gónadas y cuando el período reproductivo fue el más alto. Posteriormente se presentó una disminución de la condición hacia los meses fríos y esto se debió al gasto energético ocupado para el crecimiento de las crías y a las condiciones ambientales adversas que se registran en la zona de estudio. Este mismo comportamiento para el factor de condición fue reportado por Vargas & de Sostoa (1996) para G. holbrooki.
El crecimiento en juveniles es muy rápido, consecuencia de ser organismos capaces de comenzar a alimentarse casi inmediatamente después de la eclosión y se ha observado en el laboratorio y en el campo que especies de la misma familia, tienen tasas de crecimiento de 0.2 mm a 0.3 mm/día (Snelson 1989) y en el estado adulto los machos cesan de crecer después de alcanzar la madurez sexual (Vargas & de Sostoa 1996). Por lo tanto, el crecimiento presentado por H. bimaculata es posible que se ajuste al que muestran otras especies de la misma familia, ya que al comparar las curvas de crecimiento por sexo de H. bimaculata, se observa que los machos alcanzan la talla asintótica en menor tiempo que las hembras por efecto de la tasa de crecimiento y en general los machos crecen después de la madurez entre un 20 y 50% con respecto a la tasa de crecimiento de las hembras, aunque esta observación no se aplica para todos los poecílidos (Snelson 1989).
Ricker (1979) indica que el crecimiento de las hembras de los poecílidos es exponencialmente lento, como el que presentan los grandes peces, condición que en las hembras de H. bimaculata se presenta porque son más grandes en longitud y poseen mayor peso que los machos (Rosen & Bailey 1963). Sin embargo, altas tasa de crecimiento favorecen la sobrevivencia de los juveniles, porque si ellos son grandes, pueden alimentarse sobre grandes presas y evitar la depredación y por lo tanto, disminuir su tasa de mortalidad (Vargas & de Sostoa 1996). Asimismo, los machos alcanzan su estado adulto en menor tiempo y por consiguiente su etapa reproductiva, por lo que poseen menor longevidad. Rickter y Efanov (citados en Sparre 1992) demostraron que los peces con una alta mortalidad natural maduran a temprana edad de la vida, compensando la alta mortalidad mediante una reproducción más temprana, y en la mayoría de las especies los machos envejecen y mueren a más temprana edad que las hembras.
Porque el análisis de distribución de frecuencias de tallas ha sido considerado como no satisfactorio por varios autores, los cuales recomiendan la lectura de los otolitos como la mejor técnica para determinar la edad de los peces de vida corta (Snelson 1989), se considera que los valores obtenidos mediante el método utilizado en el presente estudio es adecuado, ya que la complejidad de los factores sociales, ambientales y genéticos no controlables en la naturaleza, pueden influir en el crecimiento, la maduración y reproducción de la especie.
El agua que entra al embalse presenta buena oxigenación, pH ligeramente ácido con tendencia hacia la basicidad y con carga de sedimentos y nutrimentos durante la temporada de lluvias. Snelson (1989) menciona que sólo dos parámetros ambientales abióticos, la temperatura y el pH se han mostrado a influir en la proporción sexual y que su efecto sobre la maduración y el crecimiento de los organismos es muy significativo, pero éste varía de especie a especie. Por otra parte, por el grado de dureza total, el agua de la laguna se puede considerar como agua moderamente dura y por la alcalinidad total como productiva (Alejo et al. 1989), por lo cual se cree que la especie en estudio encuentra condiciones adecuadas para desarrollarse en el sistema acuático en cuestión.
Agradecimientos
Se agradece a Salvador Contreras-Balderas, Ma. Teresa Gaspar-Dillanes, Samuel Gómez-Aguirre y Francisco Barba-Torres sus comentarios y sugerencias así como la revisión crítica del documento. El presente estudio se llevó a cabo con el apoyo de la F.E.S. Zaragoza, UNAM y de la Delegación de Pesca del Estado de Morelos.
Resumen
De diciembre de 1986 a diciembre de 1987 se determinaron algunos aspectos de reproducción y crecimiento de Heterandria bimaculata de la laguna "El Rodeo", Morelos, México. Los resultados obtenidos muestran que de los 1 421 organismos recolectados, el 60.12% corresponden a hembras, el 34.98% a machos y el 4.89% a juveniles; con proporción sexual a favor de las hembras de 1.7: 1 (hembras: machos ;p<0.05). La talla de primera reproducción para los machos fue de 22 mm de longitud patrón y para las hembras de 27 mm; múltiples desoves posiblemente se realicen durante el ciclo reproductivo (de marzo mayo y de julio a octubre) principalmente durante la temporada de lluvias. En julio se registró el valor más alto del indice gonadosomático (4.7%) y del factor de condición. El contenido de embriones en las gónadas fue de 5 a 78 con promedio de 23 y la fertilidad se asoció en mayor porcentaje con la longitud patrón (rd= 93.22%). Se encontró relación directa entre el peso total y la longitud patrón para esta especie y, la logitud patrón asintótica para los machos fue de 64 mm y para las hembras de 81 mm, con mayor tasa de crecimiento para estas últimas.
Referencias
Alejo, P.M.C., M.E.L. Marín & P.R. Tlalpan. 1989. Estudio de algunos aspectos Biológicos de Oreochromis mossambicus (Osteichthyes: Cichlidae) en la Laguna "El Rodeo", Estado de Morelos. Tesis de Licenciatura, Escuela Nacional de Estudios Profesionales Zaragoza, Universidad Nacional Autónoma de México, México, 129 p. [ Links ]
Anónimo. 1980. Standard Methods for the Examination of Water and Wastewater. American Public Health Association. Washington, D.C. 874 p. [ Links ]
Barlow, J. 1992. Nonlinear and logist growth in experimental populations of guppies. Ecology 73: 941-950. [ Links ]
Cabrera, P.J. & Y.L. Solano. 1995. Fertilidad y fecundidad en Poeciliopsis turrubarensis (Pisces: Poeciliidae). Rev. Biol. Trop. 43: 317-320. [ Links ]
Chapman, A.F., S.A. Fitz-Coy, E.M. Thunberg & C.M. Adams. 1997. United States of America Trade in Ornamental Fish. J. World Aquacul. Soc. 28: 1-10. [ Links ]
Constantz, D.G. 1989. Reproductive Biology of Poeciliid Fishes, p. 33-50. In: Meffe, G.K. & F.F. Snelson Jr. (eds). Ecology and Evolution of Livebearing Fishes (Poeciliidae). Prentice-Hall, Englewood Cliffs, Nueva Jersey. [ Links ]
Contreras-McBeath, T & H. E. Ramírez. 1996. Some aspects of the Reproductive Strategy of Poeciliopsis gracilis (Osteichthyes: Poeciliidae) in the Cuautla River, Morelos, Mexico. J. Freshwater Ecol. 11: 327-338. [ Links ]
Espinoza, P.H., M.T D. Gaspar & P.M. Fuentes. 1993. Listados Faunísticos de México. III. Los Peces Dulceacuícolas Mexicanos. Instituto de Biología, Universidad Nacional Autónoma de México. 99 p. [ Links ]
Farr, A.J. 1989. Sexual Selection and Secondary Sexual Differentiation in Poeciliids: Determinants of Male Mating Success and the Evolution of Female Choice, p. 91-123. In: Meffe, G.K. & F.F. Snelson Jr. (eds). Ecology and Evolution of Livebearing Fishes (Poeciliidae). Prentice-Hall, Englewood Cliffs, Nueva Jersey. [ Links ]
Gaspar-Dillanes, M.T. 1987. Nuevo registro de Heterandria (Pseudoxiphophorus) bimaculata (Heckel, 1848) en la vertiente del Pacífico Mexicano. (Pisces: Poeciliidae). An. Inst. Biol. UNAM, Ser. Zool. (2): 933-938. [ Links ]
Hubbs, C. & D. T. Mosier. 1985. Fecundity of Gambusia gaigei. Copeia 4: 1063-1064. [ Links ]
Meffe, G.K. & F.F. Snelson Jr. 1989. An Ecological Overview of Poeciliid Fishes, p. 13-31. In: Meffe, G.K. & F.F. Snelson Jr. (eds). Ecology and Evolution of Livebearing Fishes (Poeciliidae). Prentice-Hall, Englewood Cliffs, Nueva Jersey. [ Links ]
Mendoza, G. 1962. The reproductive cicles of three viviparous teleosts, Alloophorus robustus, Godea luitpoldii and Neoophorus diazi. Biol. Bull. 123: 351-365. [ Links ]
Miller, R.R. 1974. Mexican Species of the Genus Heterandria, Subgenus Pseudoxiphophorus (Pisces: Poeciliidae). San Diego Soc. Nat. Hist. Trans. 17: 235-250 [ Links ]
Parenti, R.L. & M. Rauchenberger. 1989. Systematic Overview of the Poeciliines, p. 3-31. In: Meffe, G.K. & F.F. Snelson Jr. (eds). Ecology and Evolution of Livebearing Fishes (Poeciliidae). Prentice-Hall, Englewood Cliffs, Nueva Jersey. [ Links ]
Pauly, D. 1983. Algunos Métodos Simples para la Evaluación de Recursos Pesqueros Tropicales. FAO. Doc. Téc. Pesca (234): 49 p. [ Links ]
Pauly, D. & J. Caddy. 1985. A modification of Bhattacharya's method for the separation of normal distributions. FAO Fish. Circ. 781. 16 p. [ Links ]
Reza, U.B.S. & P.E. Díaz. 1994. Algunos aspectos de la biología reproductiva de Heterandria bimaculata (POECILIIDAE). Resúmenes, IV Congreso Nacional de Ictiología, Morelia, Michoacán, México: 57-58. [ Links ]
Reznick, N.D. & D.B. Miles. 1989. A Review of Life History Patterns in Poeciliid Fishes, p. 125-148. In: Meffe, G.K. & F.F. Snelson Jr. (eds). Ecology and Evolution of Livebearing Fishes (Poeciliidae). Prentice-Hall, Englewood Cliffs, Nueva Jersey. [ Links ]
Reznick, N.D., D.B. Miles & S. Winslow. 1992. Life History of Poecilia picta (Poeciliidae) from the Island of Trinidad. Copeia 3: 782-790. [ Links ]
Ricker, W.E. 1975. Handbook of Computations for Biological Statistics of the Fish Populations. Bull. Fish. Res. Bd. Can. 191. 382 p. [ Links ]
Ricker, W.E: 1979. Growth rates and models, p. 677-743. In: Hoar, W.S., D.J. Randall & J.R. Brett (eds). Fish Phisiology. Vol. 8 Academic, Nueva York. [ Links ]
Rosen D.E. & R.M. Bailey. 1963. The Poeciliid Fishes (Cyprinodontiformes) their Structure Zoogeography and Systematics. Bull. Amer. Mus. Natur. Hist. 126. 176 p. [ Links ]
Schoenherr, A.A. 1977. Density dependent and density independent regulation of reproduction in the gila topminnow, Poeciliopsis occidentalis (Baird and Girard). Ecology 58: 438-444. [ Links ]
Scott, W P. 1987. An interpret guide to livebearing fishes. Salamander, Londres. 117 p. [ Links ]
Snelson, F.F.Jr. 1984. Seasonal maturation and growth of males in a natural population of Poecilia latipinna. Copeia 1: 252-255. [ Links ]
Snelson, F.F.Jr. 1989. Social and Enviromental Control of Life History Traits in Poeciliid, p. 149-161. In: Meffe, G.K. & F.F. Snelson Jr. (eds). Ecology and Evolution of Livebearing Fishes (Poeciliidae). Prentice-Hall, Englewood Cliffs, Nueva Jersey. [ Links ]
Sparre, P. 1992. Introducción a la evaluación de recursos pesqueros tropicales. Parte 1. Manual FAO Chile: 1-245. [ Links ]
Sumner, I.T.; J. Travis & C.D. Johnson. 1994. Methods of female fertility advertisement and variation among males in responsiveness in the sailfin molly (Poecilia latipinna) Copeia 1: 27-34. [ Links ]
Tesch, F.W. 1968. Age and growth, p. 93-123. In: W.E. Ricker, (ed). Methods for assessment of fish production in fresh waters. Blackwell Scientific, Oxford (IBP Handbook No. 3). [ Links ]
Vargas M.J. & A. de Sostoa. 1996. Life history of Gambusia holbrooki (Pisces, Poeciliidae) in the Ebro delta (NE Iberian Peninsula). Hydrobiologia 341: 215-224. [ Links ]
1 Laboratorio de Limnología, Facultad de Estudios Superiores Zaragoza, Campus II, UNAM. Batalla del 5 de Mayo esq. Fuerte de Loreto, Col. Ejército de Oriente. C.P. 09230, México, D.F. Fax 7 73 01 51, e-mail: luis@puma2.zaragoza.unam.mx












 uBio
uBio