Revista Costarricense de Cardiología
ISSN 1409-4142
Origen anómalo de la arteria coronaria izquierda originándose de la arteria pulmonar. Reporte de caso y revisión de literatura
José Jiménez Vegaa, Rafael Gutiérrez Álvarezb, Manu Madhokc, Kelly Gleasonc
a. Universidad de Ciencias Médicas, San José, Costa Rica. Teléfono (506) 851-5629; Fax (506) 236 2363. Apartado postal 911-1100 Tibás, San José, Costa Rica. E-mail: mjvega@msn.com
b. Servicio de Cardiologia, Hospital Nacional Niños "Dr. Carlos Sáenz Herrera", San José, Costa Rica.
c. Servicio de Emergencias, Children´s Hospitals and Clinics of Minnesota, EEUU.
Resumen
Se presenta el caso de un lactante de 2 meses de edad que consultó por tos y dificultad respiratoria; al ser admitido en el servicio de urgencias, el abordaje inicial fue de una infección respiratoria baja (bronquiolitis) pero la evolución tórpida y la presencia de cardiomegalia hizo sospechar una cardiopatía, diagnosticándose origen anómalo de la arteria coronaria izquierda que nace de la arteria pulmonar, la cual fue tratada quirúrgicamente con resultado favorable.
Palabras Clave: Dificultad respiratoria - cardiomegalia - Origen anómalo de la arteria coronaria izquierda.
Abstract
2 month old male who was brought to the emergency department with a history of non productive cold, was noticed with difficulty breathing. He was admitted with the possible diagnosis of bronquioloitis. The poor evolution of the patient, and the presence of cardiomegaly, made the physicians look for a cardiopathy, and a diagnosis of anomalous left coronary artery from the pulmonary artery was made. He was stabilized and then was taken to the operating room and had his anomalous coronary artery reimplanted to his aorta
Keywords: Respiratory Distress – Cardiomegaly - Anomalous Left Coronary Artery Pulmonary Artery.
Introducción
El origen anómalo de la arteria coronaria izquierda naciendo de la arteria pulmonar es una anormalidad congénita rara, que representa sólo el 0,25-0,5% de todos los defectos congénitos del corazón1,2. El tratamiento definitivo es quirúrgico, cuyo fin es asegurar el flujo desde la aorta hacia la arteria coronaria izquierda e interrumpir el flujo coronario hacia la circulación pulmonar.
Caso clínico
Lactante masculino de 2 meses de edad, previamente asintomático, consulta al servicio de emergencias por cuadro progresivo de tos no productiva de 2 días de evolución, además, dificultad respiratoria y emesis posterior a los accesos de tos. No hay historia de dificultad para la alimentación. Antecedentes familiares e historia médica previa sin datos relevantes.
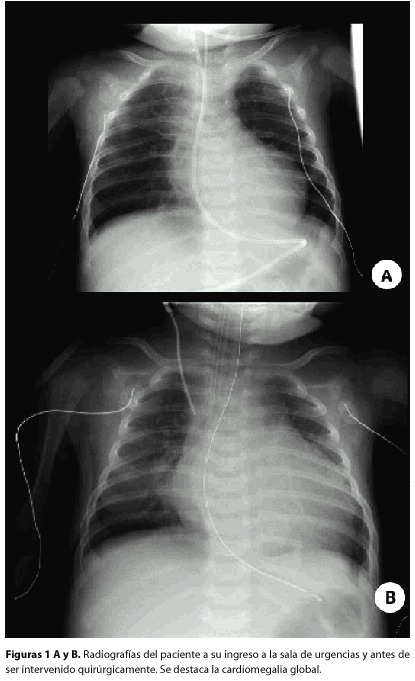
El examen físico inicial mostró signos de dificultad respiratoria leve, sin evidencia de infección de vía aérea superior. Se tomaron muestras para detectar virus respiratorio sincitial e influenza, las cuales resultaron negativas. Además, se le realizó una radiografía de tórax, la cual mostró silueta cardiaca agrandada (figura 1-A).
Debido a su dificultad respiratoria, y la negatividad de los exámenes, se le admitió al hospital por sospecha de un cuadro de bronquiolitis. El paciente se encontraba estable al inicio pero súbitamente empeoró su dificultad respiratoria.
Los signos vitales mostraron una temperatura de 35,4 grados Celsius, pulso en 190 por minuto, frecuencia respiratoria en 68 por minuto, presión arterial de 77/56 mmHg, saturación del 90%. Al examen físico, el paciente se encontró levemente somnoliento y con poca respuesta a estímulos. La fontanela anterior se encontró deprimida y los ojos secos. A la auscultación, presentó sibilancias, aunque con un buen movimiento del aire, mientras que a la auscultación cardiaca se encontró taquicárdico, sin soplos. El abdomen era blando, depresible, no distendido, con hígado palpable 3 cm por debajo del reborde costal. Las extremidades se encontraron frías, con pulsos débiles y llenado capilar mayor de 5 segundos.
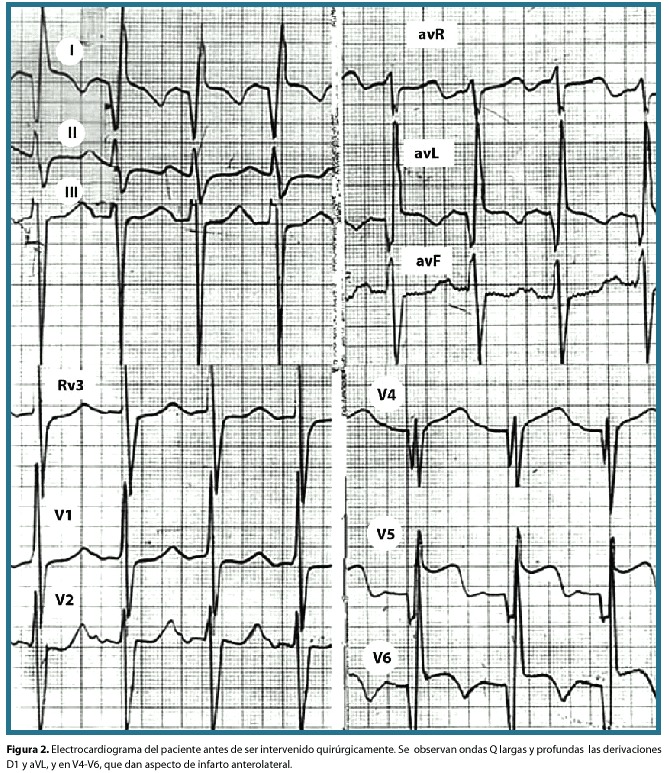
El paciente fue transferido a la unidad de cuidados intensivos pediátricos en donde se le administró una nebulización con epinefrina racémica, la cual fue inefectiva en aliviar su distrés respiratorio por lo que se decidió intubar al paciente. La radiografía de tórax en ese momento mostró cardiomegalia y aumento del flujo pulmonar. Se realizó una interconsulta al servicio de cardiología que indicó soporte inotrópico (figura 1-B). El electrocardiograma que se muestra en la figura 2, presenta ritmo sinusal. El ecocardiograma mostró dilatación del ventrículo izquierdo (4 cm en diástole), con una fracción de acortamiento menor del 10%. No había defectos septales ni anormalidades valvulares pero sí se visualizó un origen anómalo de la arteria coronaria izquierda naciendo de la arteria pulmonar. Una vez estabilizado el paciente se llevó a la sala de operaciones para reimplantar la arteria coronaria anómala a la aorta. El transoperatorio cursó sin complicaciones. Fue dado de alta con tratamiento farmacológico con Digoxina 20 ug bid y Enalapril 0,5 mg/d ambos por vía oral, así como indicación de profilaxis antibiótica para endocarditis infecciosa cuando lo amerite.
Discusión
El origen anómalo de la arteria coronaria izquierda naciendo de la arteria pulmonar, también conocido como Síndrome de Bland Garland – White o ALCAPA por sus siglas en inglés (abnormal left coronary artery from pulmonar artery) es una anormalidad congénita rara, afectando a uno en 300.000 nacidos vivos1. Alrededor del 60-85% de los pacientes afectados mueren en los primeros dos años de vida, principalmente a causa de un infarto agudo del miocardio que puede ocurrir pocas semanas después del nacimiento o por insuficiencia cardiaca congestiva3,4. La arteria coronaria izquierda anómala es un delgado y pequeño vaso, semejando un canal venoso5,6,7. Se cree que la alteración embriológica que la produce es una falla en la conexión del plexo subepicárdico, el cual se une a la porción del tronco arterioso que luego dará origen a la arteria pulmonar8. La arteria coronaria derecha nace normalmente del seno aórtico, y se torna tortuosa y dilatada, especialmente en pacientes que sobreviven la infancia4. La porción del ventrículo izquierdo que es irrigado por la arteria coronaria anómala es delgado, dilatado7 y en ocasiones aneurismático9. Esta porción hipoperfundida, pero viable aumenta su masa debido a la eplicación e los miocitos secundaria al estímulo hipoxémico10.
Durante el periodo neonatal, las resistencias vasculares pulmonares elevadas y la elevada presión pulmonar provocan flujo anterógrado desde la arteria pulmonar a la arteria coronaria anómala. Una vez que las resistencias pulmonares caen, se produce restricción del flujo sanguíneo al miocardio ventricular izquierdo, consistente con el gradiente de presión y secuestro de sangre a través de la arteria coronaria izquierda, lo cual lleva a la disminución de la contracción ventricular izquierda con cambios degenerativos de los músculos papilares, incompetencia de la válvula mitral y arritmias11. Estas anormalidades no son detectables durante el período fetal. La circulación colateral que se encarga de suplir a las arterias coronarias, puede ser la causa de un curso clínico asintomático, e inclusive de la sobrevida del paciente. Las anastomosis intercoronarias se van a desarrollar para permitir el paso a contracorriente de la arteria coronaria derecha hacia la coronaria izquierda y su territorio y también hacia la arteria pulmonar. El desarrollo de esta circulación colateral condiciona la sobrevida y la calidad de vida del paciente.
Los signos y síntomas relacionados a esta condición pueden ser inespecíficos: pérdida del apetito, fatiga asociada con la alimentación, irritabilidad y falra de crecimiento9,12; puede presentarse abombamiento de la región precordial13, taquicardia, apnea, arritmias e infarto agudo del miocardio11. El pulso alternante refleja la falla ventricular izquierda7. El choque de punta es anormal y puede acompañarse de frémito de la regurgitación mitral. La auscultación puede revelar soplos cardiacos, sistólicos, diastólicos, continuos, o bien estar ausentes. El soplo holosistólico de la regurgitación mitral es un importante hallazgo auscultatorio: este es resultado de la isquemia o infarto de los músculos papilares y la pared ventricular izquierda4,14,15,16,17,18. Además, la regurgitación mitral impone una sobrecarga adicional a un ventrículo anormal y puede ser la forma de presentación el cuadro clínico en el lactante, niño u adulto19,20. Soplos mesodiastólicos cortos son similares a aquellos auscultados en otras formas de regurgitación mitral pura18.
La radiografía de tórax muestra una silueta cardiaca que varía de cardiomegalia en pacientes severamente enfermos8,21, a normal o casi normal en algunos niños y adultos22. A nivel pulmonar, los hallazgos se relacionan con la congestión venosa que acompaña a la falla ventricular. La dilatación de cámaras izquierdas es la característica radiológica más común7,9,21,23. En el electrocardiograma, el ritmo sinusal es lo usual, aún en la presencia de regurgitación mitral15,20.
Existen signos típicos de infarto anterolateral; las ondas Q largas y profundas aparecen típicamente en las derivaciones D1 y aVL, y en V4-V64,12,24,25 y raramente aparecen en las derivaciones precordiales derechas. Es frecuente encontrar signos de hipertrofia ventricular izquierda con desviación del eje hacia la izquierda4,22,26. El mecanismo de la desviación del eje hacia la izquierda es desconocido, pero puede relacionarse en parte a el grosor desproporcionado de la pared posterobasal16,19.
La ecocardiografía muestra dilatación del ventrículo y atrio izquierdos y disminución importante de la contractilidad miocárdica y la función sistólica. En la mayoría de los casos puede observarse el nacimiento de la coronaria izquierda a partir del tronco pulmonar; además se observa un flujo diastólico, sistólico o continuo que ingresa a nivel posterior del tronco pulmonar, distalmente a la válvula y transversamente de la pared medial del tronco pulmonar19,28.
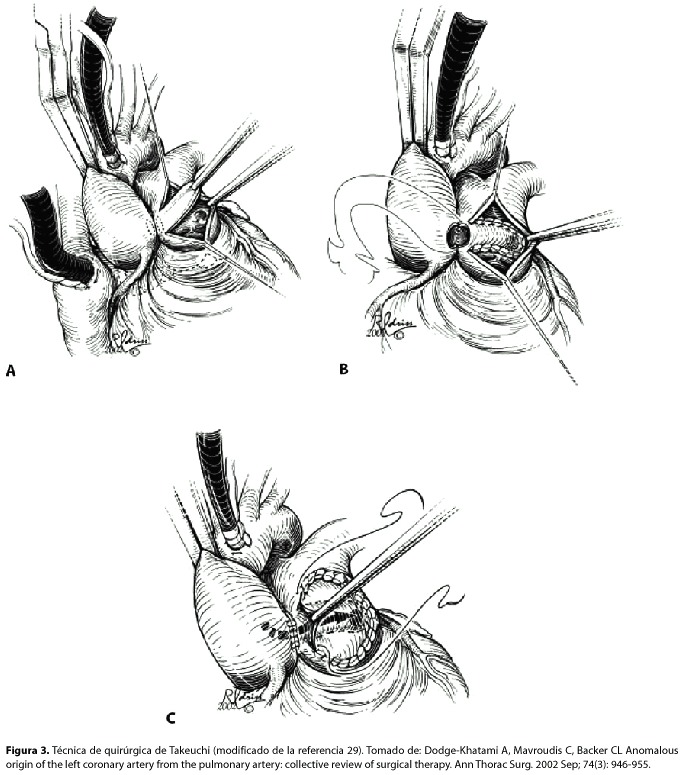
El tratamiento de esta patología es quirúrgico, su principal objetivo es detener el escape del flujo sanguíneo de la circulación coronaria a la circulación pulmonar y asegurar la reperfusión normal de la arteria coronaria izquierda hacia su territorio. Los pacientes adultos, incluso aquellos que se encuentran asintomáticos, deben de ser tratados quirúrgicamente por el alto riesgo de muerte súbita. En lactantes gravemente enfermos, se puede realizar una intervención paliativa, a pesar de que es menos recomendable que la reparación primaria; consiste en realizar una ligadura simple de la arteria coronaria izquierda anómala en la proximidad de su origen de la arteria pulmonar. La intervención definitiva implica la restauración del flujo normal de la coronaria izquierda desde la aorta. Neche28 fue el primero en describir la reimplantación directa de la arteria coronaria a la aorta usando una porción de la arteria pulmonar. Esta técnica representa la forma anatómica y más popular de corrección de esta malformación. Este procedimiento, puede ser más complicado y con mayores secuelas en adultos,debido a la friabilidad, disminución de la elasticidad de los vasos para su movilización y el potencial de ruptura y sangrado catastrófico. Takeuchi30, propuso una solución quirúrgica para los casos en donde la reimplantación directa no es posible debido a una anatomía coronaria poco favorable. La cirugía de reconexión arterial transpulmonar de la coronaria izquierda anómala o reparación de Takeuchi es la técnica de reparación mas aceptada para este tipo de casos. Se crea un colgajo en la pared anterior de la arteria pulmonar, luego se crea una ventana aorto pulmonar con incisiones previas en aorta y arteria pulmonar principal; la ventana aorta pulmonar se completa suturando la aorta con la arteria pulmonar, el túnel es construido al suturar el colgajo a través de la pared posterior de la arteria pulmonar principal y se reestablece el flujo sanguíneo desde la aorta a través de la ventana aorto-pulmonar. La arteria pulmonar es reconstruida con un parche de pericardio (figura 3) La mortalidad operatoria para todas las técnicas quirúrgicas se encontraba en un rango del 75 – 80% en la década de los ochentas, pero ha disminuido hasta un 0 – 23% en la actualidad29. La literatura al día de hoy no reporta diferencia en página la mortalidad o en la función del ventrículo izquierdo de las técnicas quirúrgicas que restablecen una circulación coronaria. Entre las complicaciones de estos procedimientos quirúrgicos se encuentran estenosis pulmonar supravalvular, fístulas coronarias hacia la arteria pulmonar e insuficiencia de la válvula aórtica. Reintervenciones a través de cateterismo son necesarias en al menos 30% de los pacientes para corregir estas complicaciones29.
Referencias
1. Bland EF, White PD, Garland J. Congenital abnormalities of coronary arteries; report of an unusual case associated with cardiac hypertrophy. Am J Cardiol 1933; 8: 787-801. [ Links ]
2. Gasul Bm, Arcilla RA, Lev MJB (1966) Heart disease in children. Diagnosis and treatment. Lippincott, Philadelphia 1966; 976. [ Links ]
3. Agusstson, MH, Gasul, BM, Graetinger JS, Bicoff, JP, Waterman DF. Anomalous origin of the left coronary artery from the pulmonary artery. Diagnosis and treatment of infantile and adult type. JAMA 1962; 15: 180. [ Links ]
4. Case, RB, Morrow AG, Stainsby, W, and Nestor JO. Anomalous origin of the left coronary artery. Circulation 1958; 17: 1062. [ Links ]
5. Keith, JD. Anomalous origin of the left coronary artery from the pulmonary artery. Br Heart J 1959; 21: 149. [ Links ]
6. Boostein, JJ. Aberrant left coronary artery. Am J. Roentgenol 1964; 37: 159. [ Links ]
7. Perloff, JK. The increase and regression of ventricular mass. In Perloff, JK, Child J. S. Congenital heart disease in Adults. Philadelphia, [ Links ]
8. Takeuchi S, Imamura H, Katsumoto K, et al. New surgical method for repair of anomalous left coronary artery from pulmonary artery. J Thorac Cardiovasc Surg 1979; 78: 7–11. [ Links ]
9. Noren, GR, Raghib, G, Moller, JH, Amplatz K, Adams P, Edwards JE. Anomalous origin of the left coronary artery from the pulmonary trunk with special reference to the occurrence of mitral insufficiency. Circulation 1964; 30: 171. [ Links ]
10. Perry, LW, Scott LP. Anomalous origin of the left coronary artery from the pulmonary artery. Circulation 1970; 41: 1043. [ Links ]
11. Askenazi J, Nadas AS Anomalous left coronary artery originating from the pulmonary artery. Report on 15 cases. Circulation 1975; 51: 976-987. [ Links ]
12. Burch, GE, DePasquale NP. The anomalous left coronary artery. An experiment of nature. (Editorial) Am. J. Med 1964; 37: 159. [ Links ]
13. Burchell, HB, Brown, AL. Anomalous origin of the left coronary artery from the pulmonary artery masquerading as mitral insufficiency. Am Heart J. 1962; 63: 388. [ Links ]
14. Davachi, F, Moller, JH, Edwards JE, Disease of the mitral valve in infancy. Circulation 1971; 43: 565. [ Links ]
15. Usman, A, Fernandez B, Uricchio, JF, Nichols HT. Aberrant origin of the left coronary artery combined with mitral regurgitation in an adult. Am. J. Cardiol. 1961; 8: 130. [ Links ]
16. Sabitson, DC, Neill, CA, Taussig HB. The direction of blood flow in anomalous left coronary artery arising from the pulmonary artery. Circulation 1960; 22: 591. [ Links ]
17. Perloff, JK, Roberts NK, Cabeen WR. Left axis deviation. Circulation 1979; 60: 12. [ Links ]
18. Sabitson, DC, Pelargonio S, Taussig HB. Myocardial infarction in infancy. J. Thorac Cardiovasc. Surg 1960; 40: 321. [ Links ]
19. Stein, HL, Hagstrom JWC, Ehlers, KH and Steinberg I. Anomalous origin of the left coronary artery from the pulmonary artery. Angiographic and pathologic study of a case. Am J. Roentgenol 1965; 93: 812. [ Links ]
20. Perloff, JK, Roberts WC. The mitral apparatus. Circulation 1972; 46: 227. [ Links ]
21. Flaherty, JT, Spach MS, Boineau, JP, Canent, RV, Barr, RC, Sabiston, DC. Cardiac potentials on body surface of infants with anomalous origin of the left coronary artery (myocardial infarction). Circulation 1967; 36: 345. [ Links ]
22. Canter, CE, Gutierrez, Fr, Spray TL, Martin, TC. Diagnosis of anomalous origin of the left coronary artery arising from the pulmonary trunk by color Doppler echocardiography. Am Heart J 1988; 116: 885. [ Links ]
23. Cronk, ES, Sinclair JG, Rigdon, RH. An anomalous origin of the left coronary artery arising from the pulmonary artery. Am Heart J 1962; 64: 690. [ Links ]
24. Houston, AB, Pollock JCS, Doig WB, Gnanapragasam, J, Jameson, MPG, Lilley, S, Murtagh, EP. Anomalous origin of the left coronary artery from the pulmonary trunk. Elucidation with colour Doppler flow mapping. Br Heart Jl 1990; 63: 50. [ Links ]
25. Hirakow R: Development of the cardiac blood vessels in staged human embryos. Acta Anat 1983; 115: 220-230. [ Links ]
26. Wesselhoeft, H, Fawcett, JS, Johnson, AL. Anomalous origin of the left coronary artery from the pulmonary trunk. Circulation 1968; 38: 403. [ Links ]
27. Stein, HL, Hagstrom JWC, Ehlers, KH and Steinberg I. Anomalous origin of the left coronary artery from the pulmonary artery. Angiographic and pathologic study of a case. Am J. Roentgenol 1965; 93: 812. [ Links ]
28. Neches WH, Mathews RA, Park SC, et al. Anomalous origino f the left coronary artery from the pulmonary artery. A new method of surgical repair. Circulation 1974; 50: 582–7. [ Links ]
29. Dodge-Khatami A, Mavroudis C, Backer CL Anomalous origin of the left coronary artery from the pulmonary artery: collective review of surgical therapy. Ann Thorac Surg. 2002 Sep; 74(3): 946-955. [ Links ]
30. Takeuchi S, Imamura H, Katsumoto K, et al. New surgical method for repair of anomalous left coronary artery from pulmonary artery. J Thorac Cardiovasc Surg 1979; 78: 7–11. [ Links ]